Окисление аммиака
Аммиак или нитрид водорода – активное соединение, вступающее в реакции с простыми и сложными веществами. В присутствии кислорода происходит окисление аммиака. В зависимости от условий протекания реакции аммиак может окислиться до оксида или азота.
Степень окисления
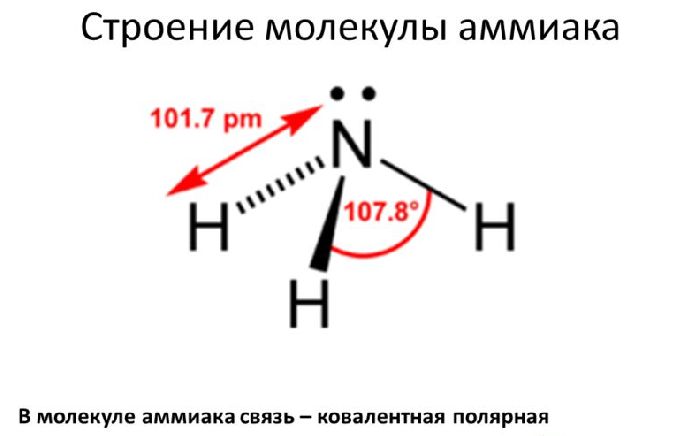
Степень окисления аммиака зависит от степени окисления элементов, входящих в его состав. На внешнем энергетическом уровне азота находится пять электронов. В составе аммиака атом азота проявляет валентность III. К трём валентным электронам присоединены атомы водорода. Следовательно, при синтезе аммиака произошло окисление азота водородом:
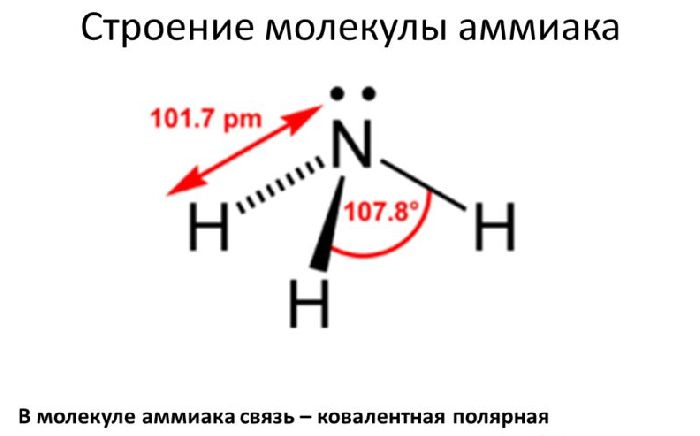
Рис. 1. Строение молекулы аммиака.
Поэтому азот имеет степень окисления -3, водород – +1.
Аммиак является восстановителем благодаря способности атома азота отдавать оставшиеся электроны и возможности атомов водорода легко отделяться.
Реакции с кислородом
За счёт оставшейся свободной пары электронов азот может окисляться водородом и кислородом. Аммиак легко притягивает катион водорода из воды или кислоты, образуя аммоний (NH4). Это производное аммиака, входящее в состав гидроксида и солей:

Рис. 2. Присоединение водорода.
При взаимодействии с кислородом может образовываться свободный азот, оксид азота (II) или (I). Конечный продукт зависит от количества начальных веществ и условий проведения реакции. На воздухе аммиак не горит.
Если на четыре объёма аммиака взять пять объёмов кислорода, то получится оксид азота (II):
Реакция протекает в присутствии катализатора. Над нагретой до 800°С платиной быстро пропускают смесь аммиака с воздухом. Платиновый катализатор могут использовать по-другому. Из платины с примесью родия, рутения, палладия делают сетку, сквозь которую пропускают аммиак и кислород. Также реакция ускоряется в присутствии оксида хрома (III).

Рис. 3. Платиновый катализатор.
Азот можно получить при нагревании концентрированного раствора аммиака в отсутствии катализатора. Сначала раствор нагревают, а затем помещают в условия чистого кислорода (четыре объёма аммиака на три объёма кислорода). Аммиак горит жёлто-зелёным пламенем:
При одинаковом объёме аммиака и кислорода образуется оксид азота (I):
Реакцию окисления проводят для получения разбавленной азотной кислоты. Для этого сначала окисляют NH3 до NO. Затем получившийся газ окисляют до диоксида азота:
Оксид азота (I) для получения кислоты окисляют и пропускают через воду:
Окисление аммиака – экзотермическая реакция, сопровождающаяся выделением тепла.

Что мы узнали?
Аммиак является восстановителем и может окисляться водородом или кислородом. В результате взаимодействия с водородом образуется аммоний – NH4. Это соединение входит в состав солей и гидроксида аммиака. С кислородом аммиак реагирует по-разному, в зависимости от условий. В присутствии катализатора образуется оксид азота (II), при нагревании, но при разных объёмах начальных веществ образуются азот и оксид азота (I).
Тест по теме
Чтобы попасть сюда – пройдите тест.
Оценка доклада
А какая ваша оценка?
Получение и основные свойства
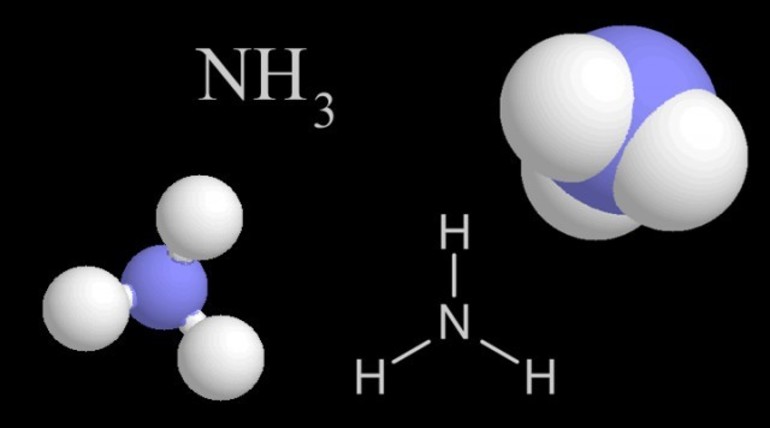
Аммиак — бинарное соединение (вещество, состоящее из двух элементов), в состав которого входят атомы водорода и азота с валентностью III. Молекула по форме напоминает пирамиду: в основании лежит треугольник из водородных атомов, а на вершине — азот. Каждая из трех связей — ковалентная полярная. Основные характеристики:

- NH3 сжижается при -33,35 °C (при высоком давлении сжижается уже при комнатной температуре).
- При -77,7 °C затвердевает.
Получают аммиак несколькими способами. Например, в лабораториях его синтезируют путем взаимодействия солей аммония со щелочами:
Это каталитические реакции, которые возможны только при нагревании. Здесь степень окисления NH3, а точнее, катиона NH4, во всех соединениях равна +1. Результатом процесса становится образование газообразного аммиака, а также хлорида и воды. Другие способы:

Кроме того, это соединение образуется и при коксовании углей (как побочный продукт).
В природе аммиак образуется при разложении азотсодержащих органических веществ. Некоторые количества этого газа можно обнаружить в дождевой воде и в воздухе. Соединение считается малоопасным. Однако превышение его концентрации в водоемах приведет к массовой гибели его обитателей. Именно по этой причине аквариумисты так тщательно следят за тем, чтобы содержание вещества в воде всегда оставалось в норме (определить содержание NH3 можно только с применением специального набора для проверки).
Химические характеристики
Однако последующее нагревание снизит реакционную способность этого газа, и он попросту улетучится.

Аммиак хорошо горит в атмосфере кислорода, хуже — на воздухе, образуя при этом (без катализатора) азот и воду, а при использовании платины в качестве ускорителя процесса — монооксид азота и H2O:
Гидроксид аммония обладает всеми свойствами оснований. Он вступает в реакцию с кислотами и кислотными оксидами:
Применение соединения
Аммиак — одно из важнейших азотных соединений. Ежегодно его производят в огромных количествах — более 100 млн тонн. Основная часть произведенного вещества идет на нужды химической промышленности. Что получают с использованием NH3:


- Удобрения.
- Кальцинированную соду — аммиак используется для насыщения солевого раствора.
- Синтез азотной кислоты — в процессе получения требуется аммиак (синтетический).
- Производство нитрата аммония (взрывчатка) — это соединение ведет себя нейтрально при механических воздействиях, однако при определенных условиях оно характеризуется высокими взрывчатыми свойствами.
- Изготовление растворителей, способных реагировать со многими органическими и неорганическими веществами.
- Хладагенты — те, что изготавливают на основе аммиака, наносят меньший вред экологии, чем «привычные» фреоны. Кроме того, аммиачные охлаждающие агенты по стоимости ниже, чем их холодильные «сородичи».
- При производстве средств бытовой химии — например, стеклоочистители, содержащие аммоний, выполняют свою «задачу» гораздо быстрее и качественнее.
- Для производства пятновыводителей (аммиачная вода отлично справляется с различными загрязнениями одежды).
Используется аммиак и в фармацевтической отрасли — для изготовления нашатырного спирта. Это соединение применяется не только как средство для устранения обмороков, но и в качестве рвотного препарата (это незаменимо при отравлениях, особенно алкогольных). Из нашатыря делают различные примочки, им обрабатывают места укуса насекомых.
А хирурги обеззараживают нашатырным раствором свои руки перед операциями.
https://youtube.com/watch?v=wM1BbhfPnzU

Нитрид водорода с формулой NH3 называется аммиаком. Это лёгкий (легче воздуха) газ с резким запахом. Строение молекулы определяет физические и химические свойства аммиака.
Строение
Молекула аммиака состоит из одного атома азота и трёх атомов водорода. Связи между атомами водорода и азота ковалентные. Молекула аммиака имеет форму тригональной пирамиды.
На 2р-орбитали азота находится три свободных электрона. С ними вступают в гибридизацию три атома водорода, образуя тип гибридизации sp3.
Если один атом водорода заменить углеводородным радикалом (CnHm), получится новое органическое вещество – амин. Замещаться может не только один атом водорода, но и все три. В зависимости от количества замещённых атомов различают три вида аминов:
- первичные (метиламин – CH3NH2);
- вторичные (диметиламин – СН3-NH-СН3);
- третичные (триметиламин – СН3-N-(СН3)2).
К молекуле аммиака могут присоединиться С2Н4, С6Н4, (С2Н4)2 и другие вещества, содержащие несколько атомов углерода и водорода.

Рис. 2. Образование аминов.
У аммиака и аминов остаётся свободной пара электронов азота, поэтому свойства двух веществ схожи.
Физические
Основные физические свойства аммиака:
- бесцветный газ;
- резкий запах;
- хорошая растворимость в воде (на один объём воды 700 объёмов аммиака при 20°С, при 0°С – 1200);
- легче воздуха.
Аммиак сжижается при температуре -33°С и становится твёрдым при -78°С. Концентрированный раствор содержит 25 % аммиака и имеет плотность 0,91 г/см3. Жидкий аммиак растворяет неорганические и органические вещества, но не проводит электрический ток.
В природе аммиак выделяется при гниении и разложении органических веществ, содержащих азот (белки, мочевина).
Степень окисления азота в составе аммиака – -3, водорода – +1. При образовании аммиака водород окисляет азот, отнимая у него три электрона. За счёт оставшейся пары электронов азота и лёгкого отделения атомов водорода аммиак является активным соединением, вступающим в реакции с простыми и сложными веществами.
Основные химические свойства описаны в таблице.

Рис. 3. Горение аммиака.
Выяснили, какими свойствами обладает аммиак. Аммиак – бесцветный лёгкий газ с резким запахом. Сжижается при низкой температуре. Раствор аммиака – хороший растворитель. Способен отдавать атомы водорода, присоединяя углеводородный радикал и образуя амины. Аммиак за счёт оставшейся электронной пары азота реагирует с простыми и сложными веществами – галогенами, кислородом, водой, кислотами, солями, оксидами.
1) HN3 – это гидрид азота (аммиак).Степень окисления водорода (H) во всех гидридах равна +1.Для нахождения степени окисления азота (N) возьмём его за x и подставим в уравнение электронейтральности
x + 3 * (+1) = 0
где +1 – степень окисления водорода x + 3 = 0 x = -3 Cтепень окисления азота равна (-3). Конечный результат: N-3H+13
CaO – оксид кальция. Степень окисления кислорода всегда равна -2 (кроме некоторых исключений, в число которых CaO не входит). Ca – металл. У металлов степень окисления всегда положительная. Возьмём её за x:
x – 2 = 0
Cтепень окисления кальция равна +2. Конечный результат: Ca2O-2
3) H2SO4 – серная кислота. Степень окисления водорода равна +1 (кроме исключений). Степень окисления кислорода всегда равна -2 (кроме исключений). Возьмём степень окисления за x и определим её с помощью простейшего уравнения:
2× (+1) + х + 4×(-2) = 0;
2 + х — 8 = 0;
x — 6 = 0;








