1. Положение углерода в периодической системе химических элементов
2. Электронное строение углерода
3. Физические свойства и нахождение в природе
4. Качественные реакции
5. Химические свойства
5.1. Взаимодействие с простыми веществами
5.1.1. Взаимодействие с галогенами
5.1.2. Взаимодействие с серой и кремнием
5.1.3. Взаимодействие с водородом и фосфором
5.1.4. Взаимодействие с азотом
5.1.5. Взаимодействие с активными металлами
5.1.6. Горение
5.2. Взаимодействие со сложными веществами
5.2.1. Взаимодействие с водой
5.2.2. Взаимодействие с оксидами металлов
5.2.3. Взаимодействие с серной кислотой
5.2.4. Взаимодействие с азотной кислотой
5.2.5. Взаимодействие с солями
Бинарные соединения углерода — карбиды
Оксид углерода (II)
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с кислородом
3.2. Взаимодействие с хлором
3.3. Взаимодействие с водородом
3.4. Взаимодействие с щелочами
3.5. Взаимодействие с оксидами металлов
3.6. Взаимодействие с прочими окислителями
Оксид углерода (IV)
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с основными оксидами и основаниями
2.3. Взаимодействие с карбонатами и гидрокарбонатами
2.4. Взаимодействие с восстановителями
Карбонаты и гидрокарбонаты
- Положение в периодической системе химических элементов
- Электронное строение углерода
- Оксид углерода (II)
- Оксид углерода (IV)
- Карбонаты и гидрокарбонаты
- Гидролиз карбонатов и гидрокарбонатов
- Советы
- Физические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Оксид углерода CO(II) – угарный газ
- Почему умирают от вдыхания угарного газа
- Оксид углерода CO2(IV) – углекислый газ
- Получение и применение углекислого газа
Положение в периодической системе химических элементов
Углерод расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и во периодической системы химических элементов Д.И. Менделеева.
Электронное строение углерода
Электронная конфигурация углерода в :
+6С 1s22s22p2 1s 2s 2p
+6С* 1s22s12p3 1s 2s 2p
Атом углерода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома углерода — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Углерод в природе существует в виде нескольких аллотропных модификаций: алмаз, графит, карбин, фуллерен.
— это модификация углерода с атомной кристаллической решеткой. Алмаз — самое твердое минеральное кристаллическое вещество, прозрачное, плохо проводит электрический ток и тепло. Атомы углерода в алмазе находятся в состоянии sp3-гибридизации.


— это аллотропная модификация, в которой атомы углерода находятся в состоянии sp2-гибридизации. При этом атомы связаны в плоские слои, состоящие из шестиугольников, как пчелиные соты. Слои удерживаются между собой слабыми связями. Это наиболее устойчивая при нормальных условиях аллотропная модификация углерода.
Графит — мягкое вещество серо-стального цвета, с металлическим блеском. Хорошо проводит электрический ток. Жирный на ощупь.


— вещество, в составе которого атомы углерода находятся в sp-гибридизации. Состоит из цепочек и циклов, в которых атомы углерода соединены двойными и тройными связями. Карбин — мелкокристаллический порошок серого цвета.


— это искусственно полученная модифицикация углерода. Молекулы фуллерена — выпуклые многогранники С60, С70 и др. Многогранники образованы пяти- и шестиугольниками, в вершинах которых расположены атомы углерода.
Фуллерены — черные вещества с металлическим блеском, обладающие свойствами полупроводников.

В природе углерод встречается как в виде простых веществ (алмаз, графит), так и в виде сложных соединений (органические вещества — нефть, природные газ, каменный уголь, карбонаты).
Качественная реакция на — взаимодействие солей-карбонатов с сильными кислотами. Более сильные кислоты вытесняют угольную кислоту из солей. При этом выделяется бесцветный газ, не поддерживающий горение – углекислый газ.
, карбонат кальция растворяется в соляной кислоте:
взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Качественная реакция на CO2 – помутнение известковой воды при пропускании через нее углекислого газа:
При дальнейшем пропускании углекислого газа осадок растворяется, т.к. карбонат кальция под действием избытка углекислого газа переходит в растворимый гидрокарбонат кальция:

взаимодействия гидроксида кальция с углекислым газом (качественная реакция на углекислый газ) можно посмотреть здесь.
Углекислый газ СО2 не поддерживает горение. Угарный газ CO горит голубым пламенем.

Основные степени окисления углерода — +4, +2, 0, -1 и -4.
Наиболее типичные соединения углерода:
При нормальных условиях углерод существует, как правило, в виде атомных кристаллов (алмаз, графит), поэтому химическая активность углерода — невысокая.
Углерод проявляет свойства (с элементами, которые расположены ниже и левее в Периодической системе) и свойства (с элементами, расположенными выше и правее). Поэтому углерод реагирует и с , и с .
Из галогенов углерод при комнатной температуре реагирует с
При сильном нагревании углерод реагирует и с образованием бинарного соединения сероуглерода и карбида кремния соответственно:
Углерод не взаимодействует
При взаимодействии углерода образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
1.4. С азотом углерод реагирует при действии электрического разряда, образуя дициан:
В реакциях с углерод проявляет свойства окислителя. При этом образуются карбиды:
При нагревании с избытком воздуха графит , образуя оксид углерода (IV):
при недостатке кислорода образуется угарный газ СО:
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:

Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
Углерод взаимодействует со
Раскаленный уголь взаимодействует с с образованием угарного газа и водорода:
Углерод восстанавливает многие металлы из основных и амфотерных . При этом образуются металл и угарный газ. Получение металлов из оксидов с помощью углерода и его соединений называют пирометаллургией.
, углерод взаимодействует с оксидом цинка с образованием металлического цинка и угарного газа:
Также углерод восстанавливает железо из железной окалины:
При взаимодействии с углерод образует карбиды.
, углерод взаимодействует с оксидом кальция с образованием карбида кальция и угарного газа. Таким образом, углерод диспропорционирует в данной реакции:
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV) и вода:
Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV) и вода:
Углерод проявляет свойства восстановителя и при сплавлении с некоторыми , в которых содержатся неметаллы с высокой степенью окисления.
, углерод восстанавливает сульфат натрия до сульфида натрия:
Карбиды это соединения элементов с углеродом. Карбиды разделяют на ковалентные и ионные в зависимости от типа химической связи между атомами.
Все карбиды проявляют свойства восстановителей и могут быть окислены .
, карбид кремния окисляется концентрированной азотной кислотой при нагревании до углекислого газа, оксида кремния (IV) и оксида азота (II):
Оксид углерода (II)
Оксид углерода (II) («угарный газ») – это газ без цвета и запаха. Сильный яд. Небольшая концентрация угарного газа в воздухе может вызвать сонливость и головокружение. Большие концентрации угарного газа вызывают удушье.
Строение молекулы оксида углерода (II) – линейное. Между атомами углерода и кислорода образуется тройная связь, за счет дополнительной донорно-акцепторной связи:

В лаборатории угарный газ можно получить действием концентрированной серной кислоты на муравьиную или щавелевую кислоты:
угарный газ получают в газогенераторах при пропускании воздуха через раскаленный уголь:
Еще один важный получения угарного газа — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
Угарный газ в промышленности также можно получать неполным окислением метана:
Оксид углерода (II) – . За счет углерода со степенью окисления +2 проявляет свойства.
Угарный газ горит в атмосфере . Пламя окрашено в синий цвет:
Оксид углерода (II) окисляется хлором в присутствии катализатора или под действием света с образованием фосгена. Фосген – ядовитый газ.
Угарный газ взаимодействует с водородом при повышенном давлении. Смесь угарного газа и водорода называется синтез-газ. В зависимости от условий из синтез-газа можно получить метанол, метан, или другие углеводороды.
, под давлением больше 20 атмосфер, при температуре 350°C и под действием катализатора угарный газ реагирует с водородом с образованием метанола:
4. Под давлением оксид углерода (II) реагирует с При этом образуется формиат – соль муравьиной кислоты.
, угарный газ реагирует с гидроксидом натрия с образованием формиата натрия:
Оксид восстанавливает металлы из .
, оксид углерода (II) реагирует с оксидом железа (III) с образованием железа и углекислого газа:
Оксиды меди (II) и никеля (II) также восстанавливаются угарным газом:
Угарный газ окисляется и другими сильными окислителями до углекислого газа или карбонатов.
, пероксидом натрия:
Оксид углерода (IV)
Оксид углерода (IV) (углекислый газ) — газ без цвета и запаха. Тяжелее воздуха. Замороженный углекислый газ называют также «сухой лед». Сухой лед легко подвергается сублимации — переходит из твердого состояния в газообразное.
Смешивая сухой лед и различные вещества, можно получить интересные эффекты. Например, сухой лед в пиве:
Углекислый газ не горит, поэтому его применяют при пожаротушении.
Молекула углекислого газа , атом углерода находится в состоянии sp-гибридизации, образует две двойных связи с атомами кислорода:

Обратите внимание! Молекула углекислого газа не полярна. Каждая химическая связь С=О по отдельности полярна, а вся молекула не будет полярна. Объяснить это очень легко. Обозначим направление смещения электронной плотности в полярных связях стрелочками (векторами):

Теперь давайте сложим эти векторы. Сделать это очень легко. Представьте, что атом углерода — это покупатель в магазине. А атомы кислорода — это консультанты, которые тянут его в разные стороны. В данном опыте консультанты одинаковые, и тянут покупателя в разные стороны с одинаковыми силами. Несложно увидеть, что покупатель двигаться не будет ни влево, ни вправо. Следовательно, сумма этих векторов равна нулю. Следовательно, полярность молекулы углекислого газа равна нулю.
В лаборатории углекислый газ можно получить разными способами:
Углекислый газ образуется при действии на карбонаты и гидрокарбонаты металлов. При этом взаимодействуют с кислотами и нерастворимые карбонаты, и растворимые.
взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Еще один : гидрокарбонат натрия реагирует с бромоводородной кислотой:
Растворимые карбонаты реагируют с растворимыми солями алюминия, железа (III) и хрома (III). Карбонаты трехвалентных металлов необратимо гидролизуются в водном растворе.
хлорид алюминия реагирует с карбонатом калия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется хлорид калия:
Углекислый газ также образуется при термическом разложении и при разложении
, карбонат кальция разлагается при нагревании на оксид кальция и углекислый газ:
Углекислый газ — типичный . За счет углерода со степенью окисления +4 проявляет слабые .
Как кислотный оксид, углекислый газ взаимодействует с . Реакция очень сильно обратима, поэтому мы считаем, что в реакциях угольная кислота распадается почти полностью при образовании.
CO2 + H2O ↔ H2CO3
2. Как кислотный оксид, углекислый газ взаимодействует с основными оксидами и основаниями. При этом углекислый газ реагирует только с сильными основаниями (щелочами) и их оксидами. При взаимодействии углекислого газа с щелочами возможно образование как кислых, так и средних солей.
, гидроксид калия взаимодействует с углекислым газом. В избытке углекислого газа образуется кислая соль, гидрокарбонат калия:
При избытке щелочи образуется средняя соль, карбонат калия:
Помутнение известковой воды — на углекислый газ:
взаимодействия гидроксида кальция (известковая вода) с углекислым газом можно посмотреть здесь.
Углекислый газ взаимодействует с . При пропускании СО2 через раствор карбонатов образуются гидрокарбонаты.
, карбонат натрия взаимодействует с углекислым газом. В избытке углекислого газа образуется кислая соль, гидрокарбонат натрия:
4. Как слабый окислитель, углекислый газ взаимодействует с некоторыми .
, углекислый газ взаимодействует с углеродом с образованием угарного газа:
Магний горит в атмосфере углекислого газа:
взаимодействия магния с углекислым газом можно посмотреть здесь.
Поэтому углекислый газ нельзя применять для пожаротушения горящего магния.
Углекислый газ взаимодействует с пероксидом натрия. При этом пероксид натрия диспропорционирует:
Карбонаты и гидрокарбонаты
При нагревании карбонаты (все, кроме карбонатов щелочных металлов и аммония) до оксида металла и оксида углерода (IV).
Карбонат аммония при нагревании разлагается на аммиак, воду и углекислый газ:
Гидрокарбонаты при нагревании переходят в карбонаты:
на ионы СО32─ и НСО3− является их взаимодействие с более сильными кислотами, последние вытесняют угольную кислоту из солей, а та разлагается с выделением СО2.
, карбонат натрия взаимодействует с соляной кислотой:
Гидрокарбонат натрия также взаимодействует с соляной кислотой:
Гидролиз карбонатов и гидрокарбонатов
Растворимые карбонаты и гидрокарбонаты гидролизуются по аниону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: CO32- + H2O = HCO3— + OH—
II ступень: HCO3— + H2O = H2CO3 + OH—
Однако карбонаты и гидрокарбонаты алюминия, хрома (III) и железа (III) гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Более подробно про гидролиз можно прочитать в соответствующей статье.
CO2 служит химическим символом для диоксида углерода. Это соединение вызывает шипение в газированной воде и многих алкоголесодержащих напитках, способствует разбуханию хлеба, выступает движущей силой для ряда аэрозолей, и является важной составляющей огнетушительной смеси. CO2 можно получить специально, либо в качестве побочного продукта других химических реакций.
- Возьмите 2-литровую пластиковую бутылку. Пользуйтесь пластиковой, а не стеклянной бутылкой: если при химической реакции резко повысится давление, пластиковая бутылка не разорвется, в отличие от стеклянной.
Если вы хотите получить CO2 для того, чтобы пополнить запасы диоксида углерода в аквариуме, такой бутылки будет как раз достаточно для 100-литрового (около 25 галлонов) аквариума. - Если вы хотите получить CO2 для того, чтобы пополнить запасы диоксида углерода в аквариуме, такой бутылки будет как раз достаточно для 100-литрового (около 25 галлонов) аквариума.
- Насыпьте в бутылку 2 чашки (473,18 мл) сахара. При этом используйте нерафинированный сахар, в котором содержится большее количество сложных соединений, и поэтому распад дрожжей займет более длительное время. Кроме того, нерафинированный сахар дешевле.
- Залейте в бутылку теплую воду до того уровня, где бутылка начинает сужаться к горлышку. Используйте теплую воду из-под крана; не заливайте горячую воду, так как она погубит дрожжевые грибки.
- Добавьте в бутылку 1/2 чайной ложки (2,46 мл) гидрокарбоната натрия. Это вещество является основным ингредиентом пищевой соды, которую легко можно приобрести в магазине.
- Добавьте 1/2 чайной ложки (2,46 мл) любого дрожжевого экстракта. Это увеличит время жизни дрожжевых грибков.
Примером дрожжевого экстракта может служить мармит, производимый в Великобритании. Из других экстрактов можно упомянуть веджимайт, боврил, ценомис. - Примером дрожжевого экстракта может служить мармит, производимый в Великобритании. Из других экстрактов можно упомянуть веджимайт, боврил, ценомис.
- Засыпьте 1/3 чайной ложки (1,64 мл) дрожжей. Пивные дрожжи бродят дольше, чем хлебные, но для наших целей будет достаточно и хлебных дрожжей, к тому же они дешевле.
- Плотно закройте бутылку крышкой.
- Взболтайте бутылку, пока дрожжи и сахар не растворятся. На поверхности воды должна появиться небольшая пена.
- Подождите от 2 до 12 часов. За это время в воде начнут образовываться пузырьки газа, что свидетельствует о выделении CO2. Если вы не увидели образования пузырьков спустя 12 часов, значит вода была слишком горячей, либо дрожжи пришли в негодность и потеряли свою активность.
Приготовленный вами раствор должен выделять примерно 2 пузырька газа каждую секунду. В случае большей интенсивности газовыделения может нарушиться уровень pH раствора. - Приготовленный вами раствор должен выделять примерно 2 пузырька газа каждую секунду. В случае большей интенсивности газовыделения может нарушиться уровень pH раствора.
- Выдохните. Ваше тело использует вдыхаемый кислород для реакции с белками, жирными кислотами и углеводами, которые вы употребляете в пищу. Одним из продуктов этой реакции является диоксид углерода, выдыхаемый вами.
Растения и некоторые виды бактерий, напротив, поглощают диоксид углерода из воздуха и при помощи солнечной энергии создают из него простые сахара (являющиеся углеводами). - Растения и некоторые виды бактерий, напротив, поглощают диоксид углерода из воздуха и при помощи солнечной энергии создают из него простые сахара (являющиеся углеводами).
- Дрожжи и сахар. Если смешать дрожжи с сахаром и водой, как было описано в Шаге 1, сахар начнет рападаться с выделением CO2. При реакции также образуется этанол (C2H5OH), то есть алкоголь, присутствующий в спиртных напитках. Данная реакция называется процессом ферментации.
Советы
- 2-литровая пластиковая бутылка с крышкой
- Вода
- Сахар
- Гидрокарбонат натрия (пищевая сода)
- Дрожжи (хлебные или пивные)
- Дрожжевой экстракт (по возможности)
4. Под давлением оксид углерода (II) реагирует с щелочами. При этом образуется формиат – соль муравьиной кислоты.
Физические свойства
Карбонат натрия Na2CO3 — соль щелочного металла натрия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 105,99; относительная плотность для тв. и ж. состояния d = 2,539; tпл = 851º C;
Способ получения
Карбонат натрия можно получить путем взаимодействия оксида натрия и углекислого газа:
Na2O + CO2 = Na2CO3
В результате взаимодействия концентрированного раствора гидроксида натрия и углекислого газа образуется карбонат натрия и вода:
2NaOH + CO2 = Na2CO3↓ + H2O
При взаимодействии гидрокарбоната натрия и концентрированного раствора гидроксида натрия образуется карбонат натрия и вода:
NaHCO3 + NaOH = Na2CO3 + H2O
Качественная реакция
Качественная реакция на карбонат натрия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
При взаимодействии с хлороводородной кислотой, карбонат натрия образует хлорид натрия, углекислый газ и воду:
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
Взаимодействуя с серной кислотой, карбонат натрия образует углекислый газ и воду, а также сульфат натрия:
Na2CO3 + H2SO4 = 2Na2SO4 + CO2↑ +H2O.
Химические свойства
Карбонат натрия может реагировать с простыми веществами:
1.1. Карбонат натрия при 900–1000º C реагирует . При этом образуется натрий и угарный газ:
Na2CO3 + 2C(кокс) = Na + 3CO
1.2. С хлором концентрированный и горячий раствор карбоната натрия реагирует с образованием хлорида натрия, хлората натрия и углекислого газа:
Na2CO3 + 3Cl2 = 5NaCl + NaClO3 + 3CO2↑
Карбонат натрия вступает в реакцию многими :
Насыщенный карбонат натрия реагирует при 30–40º C водой и образуя осадок гидрокарбоната натрия:
Na2CO3 + H2O + CO2 ↔ 2NaHCO3↓
Карбонат натрия может реагировать с образованием гидроксида натрия и карбоната кальция:
Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3
При взаимодействии карбонат натрия образует хлорид натрия, углекислый газ и воду:
Na2CO3 + 2HCl = 2NaCl + CO2↑ +H2O
Карбонат натрия реагирует разбавленной . Взаимодействие карбоната натрия приводит к образованию фторида натрия, воды и углекислого газа:
Na2CO3 + 2HF = 2NaF + H2O + CO2↑
Концентрированный раствор карбоната натрия взаимодействует . При этом образуются карбонат натрия и углекислый газ:
Na2CO3 + SO2 = Na2SO3 + CO2↑.
Оксид углерода CO(II) – угарный газ
Оксид углерода CO(II) или монооксид углерода – бесцветный газ, не имеющий запаха, плохо растворимый в воде.
Оксид углерода CO(II) рядовому обывателю более известен, как угарный газ, который стал причиной трагических смертей десятков тысяч людей.
В молекуле оксида углерода (II) атомы кислорода и углерода соединены тройной связью.
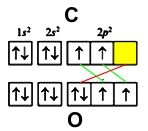
- кислорода – 1s22s22p4
- углерода – 1s22s22p2
У обоих элементов имеется по два неспаренных электрона на внешнем энергетическом уровне, которые и образуют две ковалентные связи (обозначены зеленым цветом). Третья связь образуется по донорно-акцепторному принципу – атом углерода (акцептор) предоставляет свою свободную орбиталь (желтая ячейка), на которой размещается электронная пара кислорода (донор) (красный цвет).
В молекуле угарного газа атом углерода принимает валентность 3, но степень окисления +2. По этой причине, для оксида углерода CO(II) характерны реакции присоединения, в которых он играет роль восстановителя:
- на воздухе оксид углерода CO(II) горит, образуя углекислый газ:2C+2O+O20 = 2C+4O2↑+Q
- восстановительные свойства угарного газа нашли широкое применение в металлургических процессах получения металлов из их оксидов (руд):
CO+FeO = CO2↑+FeCO+CuO = CO2↑+Cu - в присутствии угля, который выполняет роль катализатора, на свету угарный газ взаимодействует с хлором с образованием отравляющего вещества фосген:CO+Cl2 = COCl2
Поскольку монооксид углерода не образует солей, при н.у. угарный газ не взаимодействует с кислотами и щелочами.
В промышленных целях угарный газ получают взаимодействием углекислого газа с раскаленным углем:CO2+C = 2CO
Угарный газ также образуется в процессе неполного сгорания топлива:CH4+1½O2 = CO+2H2O
Именно такие случаи приводят зачастую к непоправимым трагедиям, – люди “угорают”, чаще всего в домах с печным отоплением, когда в целях сохранения тепла на ночь закрывается заслонка, препятствующая выходу продуктов горения в вытяжную трубу, но при этом дрова или уголь еще полностью не перегорели. В результате чего, образующийся угарный газ накапливается в помещении, и люди, вдыхая его во сне, умирают.
Второй, самый распространенный случай гибели людей от угарного газа – вдыхание выхлопных газов автомобиля с двигателем внутреннего сгорания в закрытом, плохо проветриваемом помещении. Сколько таких случаев было, когда водители грелись и погибали в закрытых гаражах.
Почему умирают от вдыхания угарного газа
Все дело в гемоглобине, который содержится в красных кровяных тельцах – эритроцитах. Гемоглобин – это белок, который транспортирует кислород от легких к тканям человека. Коварность угарного газа заключается в том, что CO легко преодолевает альвеолярно-капиллярную мембрану, после чего растворяется в плазме крови, и начинает “цепляться” к эритроцитам, вытесняя из гемоглобина кислород с образованием карбоксигемоглобина – в молекуле гемоглобина молекулы угарного газа соединяются с атомами железа, после чего кислород остается “не при делах”. Данная реакция происходит по причине того, что монооксид углерода в 250(!) раз более активно вступает в реакцию с гемоглобином, нежели кислород. Таким образом, поступление кислорода к тканям организма нарушается, и в течение короткого времени наступает смерть человека, который задыхается “изнутри”.
Концентрация угарного газа 1,2% в воздухе является смертельной – достаточно всего нескольких вдохов, чтобы человек потерял сознание, смерть наступает в течение 2-3 минут.
Оксид углерода CO2(IV) – углекислый газ
Молекула углекислого газа имеет линейное строение (углерод имеет валентность 4, и степень окисления +4):
Атомы углерода и кислорода связаны ковалентными полярными связями, но сама молекула неполярна.
Углекислый газ (диоксид углерода) также, как и угарный газ, не имеет цвета, запаха, плохо растворим в воде, но, растворяется лучше, чем CO. При низких температурах углекислота переходит в жидкое, а затем в твердое состояние (сухой лед).
Углекислый газ реагирует со следующими веществами:
- при растворении в воде образует угольную кислоту:CO2+H2O = H2CO3
- с основными оксидами и основаниями CO2 взаимодействует, как кислотный оксид, образуя соли, которые называются карбонатами:
Na2O+CO2 = Na2CO3 - при высоких температурах углекислый газ проявляется свойства окислителя – активные металлы могут гореть в среде углекислого газа, отнимая у него кислород:
CO2+C = 2COCO2+2Mg = 2MgO+C
Получение и применение углекислого газа
- в промышленности – обжигом известняка:CaCO3 = CaO+CO2↑
- в лаборатории – действием кислоты на соли угольной кислоты:Na2CO3+2HCl = 2NaCl+H2O+CO2↑
- в природе углекислый газ выделяется при гниении и горении органических веществ:C+O2 = CO2↑
Углекислый газ нашел широкое применение в пищевой промышленности, в качестве основного компонента газированных напитков. Сухой лед применяется в качестве охладителя. Углекислотные огнетушители применяются при тушении похара, если температура горения не превышает 1000°C.
Углерод – неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических
веществ в природе.

Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец – металлы.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C – 2s22p2
- Si – 3s23p2
- Ge – 4s24p2
- Sn – 5s25p2
- Pb – 6s26p2

Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций – графит, алмаз, фуллерен
- MgCO3 – магнезит
- CaCO3 – кальцит (мел, мрамор)
- CaCO3*MgCO3 – доломит

Углерод получают в ходе пиролиза углеводородов (пиролиз – нагревание без доступа кислорода). Также применяется получение углеродистых соединений:
древесины и каменного угля.

При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные
степени окисления.
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.

Углерод – хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их
оксидов:
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
Может восстановить и собственный оксид:

Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца – крайне важна в промышленности:
В реакциях с кислотами углерод проявляет себя как восстановитель:

Оксид углерода II – СO
Оксид углерода II – продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется
при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода
и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
Образование карбонилов – чрезвычайно токсичных веществ.

Оксид углерода IV – CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ,
без запаха.
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
Углекислый газ образуется при горении органических веществ:

В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
CO2 + H2O ⇄ H2CO3
В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние – карбонаты (при избытке основания),
кислые – гидрокарбонаты (при избытке кислотного оксида).
При нагревании способен окислять металлы до их оксидов.

Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.

Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается “закипанием” – появлением пузырьков бесцветного
газа без запаха.
Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что
при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа –
помутнение исчезало.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.

Чтобы сделать из средней соли (карбоната) – кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу
H2CO3 – ошибка. Ее следует записать в виде воды и углекислого газа.
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты – на карбонат металла, углекислый газ и воду.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.







