- Вариант 3. Получение, собирание и распознавание углекислого газа
- Опыт 1. Получение, собирание и распознавание водорода.
- Опыт 2. Получение, собирание и распознавание углекислого газа.
- Опыт 3. Изучение состава солей.
- Опыт 4. Распознавание соединений неметаллов.
- Практическая работа №6. Получение, собирание и распознавание газов
- Лабораторные способы получения неорганических веществ
- Получение углекислого газа в лаборатории
- Получение угарного газа в лаборатории
- Получение сероводорода в лаборатории
- Получение аммиака в лаборатории
- Получение азотной кислоты в лаборатории
- Получение ортофосфорной кислоты в лаборатории
- Получение кремния в лаборатории
- Получение кислорода в лаборатории
- Получение водорода в лаборатории
- Получение хлора в лаборатории
- Получение хлороводорода в лаборатории
- Похожие вопросы
Вариант 3. Получение, собирание и распознавание углекислого газа
Вариант 3. Получение, собирание и распознавание углекислого газа. При добавлении раствора уксусной кислоты к мрамору (мелу) наблюдается бурное выделение углекислого газа.

При внесении в пробирку горящей лучины лучина гаснет.
При пропускании углекислого газа через раствор известковой воды она мутнеет, а потом вновь становится прозрачной.
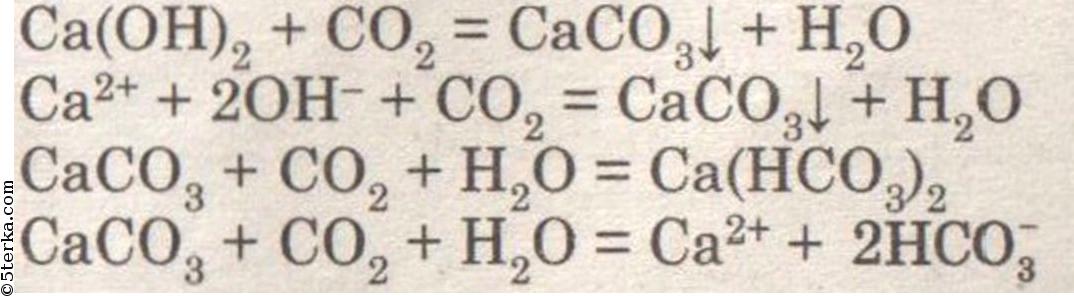

Решебник по химии за 11 класс (О.С. Габриелян, 2007 год), задача №3к главе «Практическая работа №1 Получение, собирание и распознавание газов».
Опыт 1. Получение, собирание и распознавание водорода.
Поместите в пробирку (рис. 113), закреплённую в штативе вертикально, 2 гранулы цинка и налейте 3 мл соляной кислоты. Закройте пробирку пробкой с вертикальной газоотводной трубкой. На трубку наденьте пробирку. Подождите 2-3 минуты, чтобы верхняя пробирка наполнилась водородом. Осторожно снимите пробирку с водородом и, не переворачивая её, а слегка наклонив, поднесите отверстием к пламени спиртовки. Каков характер получившегося хлопка? О чём это свидетельствует? Напишите уравнения протекающих реакций.
Опыт 2. Получение, собирание и распознавание углекислого газа.
Поместите в пробирку, закреплённую в штативе наклонно, кусочек мрамора. Налейте 2-3 мл соляной кислоты и закройте пробирку пробкой с газоотводной трубкой (рис. 114). Опустите свободный конец трубки в пробирку, содержащую известковую воду, так, чтобы пузырьки выделяющегося газа проходили через раствор. Что наблюдаете?
Напишите уравнения реакций в молекулярной и ионной формах.
Опыт 3. Изучение состава солей.
Докажите опытным путём, что в состав хлорида аммония входят катион аммония NH4 + и хлорид-анион Cl — .
Докажите опытным путём, что в состав сульфата аммония входят катион аммония NH4 + и сульфат-анион SO4 2-
Докажите опытным путём, что в состав гидрокарбоната аммония входят катион аммония NH4 + и гидрокарбонат-анион HCO3 — .
Опыт 4. Распознавание соединений неметаллов.
В четырёх пробирках под номерами без этикеток находятся кристаллические соли: сульфат калия, хлорид магния, карбонат натрия, силикат натрия. С помощью предложенных вам реактивов распознайте каждую соль, проведя качественные реакции на анионы. Напишите уравнения проведённых реакций в молекулярной и ионной формах.
При действии соляной кислоты на цинк наблюдается выделение газа:Zn + 2HCl ⟶ ZnCl2 + H2↑
При поджоге собранного газа раздаётся глухой хлопок, это свидетельствует о том, что водород не содержит примесей.2H2 + O2 ⟶ 2H2O
При действии соляной кислоты на известняк наблюдается выделение газа:CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑CaCO3 + 2H + + 2Cl — ⟶ Ca 2+ + 2Cl — + H2O + CO2↑CaCO3 + 2H + ⟶ Ca 2+ + H2O + CO2↑
При пропускании углекислого газа через известковую воду наблюдается помутнение раствора:Ca(OH)2 + CO2 ⟶ CaCO3↓ + H2OCa 2+ + 2OH — + CO2 ⟶ CaCO3↓ + H2OCa 2+ + 2OH — + CO2 ⟶ CaCO3↓ + H2O
При дальнейшем пропускании углекислого газа наблюдается растворение выпавшего карбоната кальция:CaCO3 + H2O + CO2 ⟶ Ca(HCO3)2CaCO3 + H2O + CO2 ⟶ Ca 2+ + 2HCO3 —
Доказательство того, что в состав входит катион аммония NH4 + :NH4Cl + NaOH ⟶ NH3↑ + H2O + NaClNH4 + + Cl — + Na + + OH — ⟶ NH3↑ + H2O + Na + + Cl — NH4 + + OH — ⟶ NH3↑ + H2O
Доказательство того, что в состав входит хлорид-анион Cl — :NH4Cl + AgNO3 ⟶ NH4NO3 + AgCl↓NH4 + + Cl — + Ag + + NO3 — ⟶ NH4 + + NO3 — + AgCl↓Ag + + Cl — ⟶ AgCl↓
1) Во все пробирки добавить воды.
2) Добавить щелочь. В пробирке с хлоридом магния выпадет белый осадок:MgCl2 + 2NaOH ⟶ 2NaCl + Mg(OH)2↓Mg 2+ + 2Cl — + 2Na + + 2OH — ⟶ 2Na + + 2Cl — + Mg(OH)2↓Mg 2+ + 2OH — ⟶ Mg(OH)2↓
3) Добавить соляную кислоту.
В пробирке с карбонатом натрия выделится газ:Na2CO3 + 2HCl ⟶ 2NaCl + H2O + CO2↑2Na + + CO3 2- + 2H + + 2Cl — ⟶ 2Na + + 2Cl — + H2O + CO2↑2H + + CO3 2- ⟶ H2O + CO2↑
В пробирке с силикатом натрия выпадет белый осадок:Na2SiO3 + 2HCl ⟶ 2NaCl + H2O + SiO2↓2Na + + SiO3 2- + 2H + + 2Cl — ⟶ 2Na + + 2Cl — + H2O + SiO2↓2H + + SiO3 2- ⟶ H2O + SiO2↓
4) В оставшуюся пробирку (с сульфатом калия) добавим хлорид бария, выпадет белый осадок:K2SO4 + BaCl2 ⟶ 2KCl + BaSO4↓2K + + SO4 2- + Ba 2+ + 2Cl — ⟶ 2K + + 2Cl — + BaSO4↓Ba 2+ + SO4 2- ⟶ BaSO4↓
Практическая работа №6. Получение, собирание и распознавание газов
Опыт 1. Получение, собирание и распознавание водорода
Соберите прибор для получения газов и проверьте его на герметичность. В пробирку положите 1—2 гранулы цинка и прилейте в нее 1—2 мл соляной кислоты. Закройте пробирку пробкой с газоотводной трубкой (см. рис. 43) и наденьте на кончик трубки еще одну пробирку. Подождите некоторое время, чтобы пробирка заполнилась выделяющимся газом.Снимите пробирку с водородом и, не переворачивая ее, поднесите к горящей спиртовке. Если водород взрывается с глухим хлопком, то он чистый, а если с «лающим» звуком, значит, водород собран в смеси с воздухом («гремучий газ»).
Вопросы и задания
1. Что происходит при взаимодействии цинка с соляной кислотой? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.3. Опишите физические свойства водорода, непосредственно наблюдаемые при проведении опыта.4. Опишите, как можно распознать водород.
Собрали прибор для получения газов и проверили его на герметичность. В пробирку положили 1-2 гранулы цинка и прилили в нее 1-2 мл соляной кислоты. Закрыли пробирку пробкой с газоотводной трубкой и надели на кончик трубки еще одну пробирку, подождали некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Сняли пробирку с водородом и не переворачивая ее поднесли к горящей спиртовке. Чистый водород взрывается с глухим хлопком.

Опыт 2. Получение, собирание и распознавание аммиака

Соберите прибор, как показано на рисунке 113, и проверьте его на герметичность.
В фарфоровую чашку насыпьте хлорид аммония и гидроксид кальция объемом по одной ложечке для сжигания веществ. Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте ее пробкой и укрепите в лапке штатива (обратите внимание на наклон пробирки относительно отверстия!). На газоотводную трубку наденьте сухую пробирку для собирания аммиака.
Пробирку со смесью хлорида аммония и гидроксида кальция прогрейте сначала всю (2—3 движения пламени), а затем в том месте, где находится смесь.
Для обнаружения аммиака поднесите к отверстию перевернутой вверх дном пробирки влажную фенолфталеиновую бумажку.
Прекратите нагревание смеси. Пробирку, в которой собран аммиак, снимите с газоотводной трубки. Конец газоотводной трубки сразу же закройте кусочком мокрой ваты.
Немедленно закройте отверстие снятой пробирки большим пальцем и опустите в сосуд с водой. Палец отнимите только под водой. Что вы наблюдаете? Почему вода поднялась в пробирке? Закройте пальцем отверстие пробирки под водой и выньте ее из сосуда. Добавьте в пробирку 2—3 капли раствора фенолфталеина. Что наблюдаете?
Проведите аналогичную реакцию между растворами щелочи и соли аммония при нагревании. Поднесите к отверстию пробирки влажную индикаторную бумажку. Что наблюдаете?
1. Что происходит при взаимодействии хлорида аммония и гидроксида кальция? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.2. Опишите физические свойства аммиака, непосредственно наблюдаемые в опыте.3. Опишите не менее двух способов распознавания аммиака.
Собрали прибор для получения аммиака и проверили его на герметичность. В фарфоровую чашку насыпали хлорид аммония и гидроксид кальция объемом по 1 ложечке для окисления веществ. Смесь перемешали стеклянной палочкой и высыпали в сухую пробирку. Закрыли ее пробкой и укрепили на лапке штатива. На газоотводную трубку надели сухую пробирку для собирания аммиака. Пробирку со смесью хлорида аммония и гидроксида кальция нагрели.

Опыт 1. Получение, собирание и распознавание кислорода

Соберите прибор, как показано на рисунке 114, и проверьте его на герметичность. В пробирку насыпьте примерно на ¼ ее объема перманганата калия KMnO4 и у отверстия пробирки положите рыхлый комочек ваты. Закройте пробирку пробкой с газоотводной трубкой. Укрепите пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород. Наличие кислорода в сосуде проверьте тлеющей лучинкой.
1. Что происходит при нагревании перманганата калия? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.3. Опишите физические свойства кислорода, непосредственно наблюдаемые в опыте.4. Опишите, как вы распознавали кислород.
Собрали прибор для получения кислорода и проверили его на герметичность. В пробирку насыпали примерно на 1/4 ее объема перманганата калия у отверстия пробирки положили рыхлый комочек ваты.
Закрыли пробирку пробкой с газоотводной трубкой. Укрепили пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород.

Опыт 2. Получение, собирание и распознавание оксида углерода (IV)
В пробирку поместите несколько кусочков мела или мрамора и прилейте 1—2 мл разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку, в которой находится 2—3 мл известковой воды.Несколько минут наблюдайте, как через известковую воду проходят пузырьки газа.
1. Что происходит при взаимодействии мела или мрамора с соляной кислотой? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.2. Рассмотрите проведенную реакцию в свете теории электролитической диссоциации.3. Опишите физические свойства оксида углерода (IV), непосредственно наблюдаемые в опыте.4. Опишите, как вы распознавали оксид углерода (IV).
В пробирку поместили несколько кусочков мела и прилили 1 мл разбавленной соляной кислоты. Закрыли пробирку пробкой с газоотводной трубкой. Конец трубки опустили в другую пробирку, в которой находится 2-3 мл известковой воды. Наблюдаем как через известковую воду проходят пузырьки газа.

Эта реакция является качественной на углекислый газ.
Лабораторные способы получения неорганических веществ
Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений.
Лабораторные способы получения веществ отличаются от промышленных:
Получение углекислого газа в лаборатории
Углекислый газ CO2 в лаборатории получают при помощи аппарата Киппа при взаимодействии соляной кислоты с мелом или мрамором:

Получение угарного газа в лаборатории
В лаборатории угарный газ проще всего получить, действуя концентрированной серной кислотой на муравьиную кислоту:
Получение сероводорода в лаборатории
Сероводород в лаборатории легко получить действием разбавленной серной кислоты на сульфиды металлов, например, сульфид железа (II):
Эта реакция также проводится в аппарате Киппа.
Получение аммиака в лаборатории
Аммиак в лаборатории получают при нагревании смеси солей аммония с щелочами.
Например , при нагревании смеси хлорида аммония с гашеной известью:
Эти вещества тщательно перемешивают, помещают в колбу и нагревают.

Получение азотной кислоты в лаборатории
Азотную кислоту в лаборатории получают действием концентрированной серной кислоты на кристаллический нитрат натрия и калия при небольшом нагревании:
При этом менее летучая кислота вытесняет более летучую кислоту из соли.
При более сильном нагревании образуется сульфат натрия, но и образующаяся азотная кислота разлагается.
Получение ортофосфорной кислоты в лаборатории
При взаимодействии ортофосфата кальция с серной кислотой при нагревании образуется ортофосфорная кислота:
Получение кремния в лаборатории
В лаборатории кремний получают при взаимодействии смеси чистого песка с порошком магния:
Получение кислорода в лаборатории
Кислорода в лаборатории можно получить при разложении целого ряда неорганических веществ.
Чаще всего в лаборатории кислород получают разложением перманганата калия:
Выделяющийся кислород можно собрать вытеснением воздуха:

Также кислород можно собирать методом вытеснения воды:

Обнаружить кислород можно очень просто: тлеющая лучинка вспыхивает в атмосфере кислорода.
Кислород можно получить также разложением пероксида водорода:
Реакция катализируется оксидом марганца (IV) MnO2.
Разложение бертолетовой соли KClO3 — еще один способ получения кислорода в лаборатории:
Реакция также протекает в присутствии катализатора, оксида марганца (IV) MnO2.
Получение водорода в лаборатории
Водород в лаборатории можно получить различными методами.
Под действием электрического тока вода разлагается на водород и кислород:
При взаимодействии минеральных кислот (не сильных окислителей) с активными металлами и металлами средней активности также образуется водород.
Например , соляная кислота реагирует с цинком с образованием водорода:
Собирать водород можно методом вытеснения воздуха, так как водород — гораздо более легкий газ, чем воздух.

Также для собирания водорода подходит метод вытеснения воды, так как водород плохо растворим в воде:

Водород выделяется также при взаимодействии активных металлов (расположенных в ряду активности до магния) с водой.
Например , натрий активно реагирует с водой с образованием водорода:

Получение хлора в лаборатории
Стр. 162в лаборатории можно получить различными методами.
Получение хлороводорода в лаборатории
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Похожие вопросы
- Все категории
- экономические 43,401
- гуманитарные 33,632
- юридические 17,905
- школьный раздел 607,977
- разное 16,854
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Лабораторная работа №3
«Получение углекислого газа и его распознавание»
Цель работы: экспериментально получить углекислый газ и провести опыты, характеризующие его свойства.
Оборудование и реактивы: штатив с пробирками, штатив лабораторный, прибор для получения углекислого газа, мел (мрамор), соляная кислота, известковая вода.
Ход работы:
1. Подготовьте заранее две пробирки: одну с 4 мл раствора лакмуса в дистиллированной воде (водопроводная вода не годится), другую – с 3 мл известковой воды с добавлением фенолфталеина.
2. Соберите прибор для получения газа. Поместите в пробирку несколько кусочков мела, налейте до 1/3 объема пробирки соляной кислоты и закройте пробкой с газоотводной трубкой, конец которой направлен вниз. Сделайте вывод о способе получения углекислого газа.
3. Опустите газоотводную трубку в пробирку с раствором лакмуса так, чтобы конец газоотводной трубки был ниже уровня раствора. Пропускайте углекислый газ до изменения окраски индикатора на розовую.
4. Погрузите газоотводную трубку в пробирку с известковой водой так, чтобы конец газоотводной трубки был ниже уровня раствора. Пропускайте углекислый газ до изменения окраски раствора и выпадения осадка. Если продолжать дальше пропускать углекислый газ то осадок исчезнет. Сделайте вывод о химических свойствах углекислого газа.
По итогам проведенных опытов заполните таблицу, сделайте вывод.
Задания. 1. Получите углекислый газ взаимодействием мрамора с соляной кислотой.
2. Изучите некоторые физические свойства диоксида углерода (IV) (цвет, запах, растворимость в воде, относительную плотность).
3. а) Изучите взаимодействие углекислого газа с водой;б) осуществите следующие превращения;
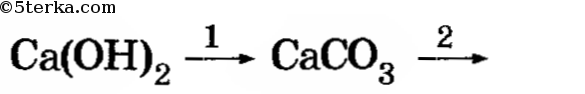
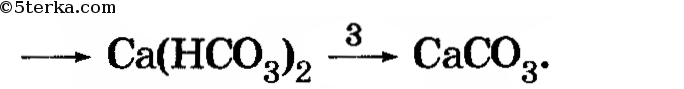
4. Распознайте известняк среди выданных образцов минералов.
5. Получите карбонат бария с помощью реакции обмена.
Оборудование. Прибор для получения газов, заправленный кусочками мрамора и соляной кислотой, лабораторный штатив, штатив с пробирками, пипетки, стаканы на 150 мл (2 шт.), картонный кружок для стакана, пробиркодержатели (2 шт.), нагревательный прибор.
Вещества. 10%-е растворы карбоната натрия и хлорида бария, 10%-я соляная кислота, известковая вода, раствор лакмуса, дистиллированная вода, минералы гипс, каолин, известняк, кварц.
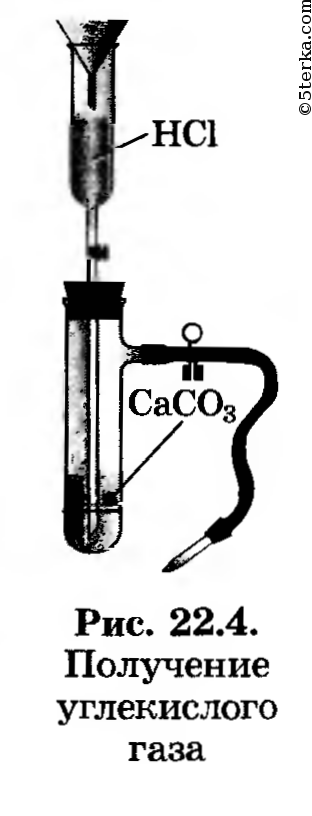
1. Получение оксида углерода (IV). Зарядите прибор для получения углекислого газа (рис. 22.4). Получите углекислый газ, соберите его в химический стакан и прикройте картонным кружком. (Для чего?)
2. Изучение свойств оксида углерода (IV). Внесите в стакан горящую спичку. Что наблюдаете? «Перелейте» содержимое в другой стакан. Убедитесь с помощью горящей спички, что углекислый газ действительно «перелился» из одного стакана в другой.
Какое свойство углекислого газа лежит в основе этого опыта? Опишите физические свойства исследуемого газа.
Налейте в пробирку (на 1 /4 ее объема) дистиллированную воду, подкрасьте ее фиолетовым раст
вором лакмуса и пропускайте через эту воду углекислый газ до изменения окраски индикатора. Почему изменилась окраска лакмуса? Составьте уравнение соответствующей реакции. Нагрейте содержимое пробирки до начала кипения. Почему снова изменился цвет лакмуса? Объясните это с помощью уравнения реакции.
3. Прилейте в пробирку (на 1/4 ее объема) известковую воду и пропускайте через нее углекислый газ. Что вы наблюдаете? Где используется в практике эта реакция? Продолжайте пропускать углекислый газ через мутную смесь до полного осветления раствора. Что произошло? Составьте уравнения наблюдаемых реакций.
Содержимое пробирки с полученным гидрокарбонатом кальция разделите на две равные части. В одну пробирку добавьте известковую воду, а другую нагрейте до начала кипения раствора. Что вы наблюдаете? Объясните происходящее явление с помощью уравнений реакций. Сделайте выводы: а) каким образом карбонаты можно превратить в гидрокарбонаты;б) как можно гидрокарбонаты превратить в карбонаты.
4. Из выданных вам минералов с помощью химических реакций определите известняк. Составьте ионные уравнения проделанной реакции.
5. Получите реакцией обмена карбонат бария. Опытным путем докажите, что выпавший осадок действительно является карбонатом. Составьте полные и сокращенные ионные уравнения проделанных реакций.
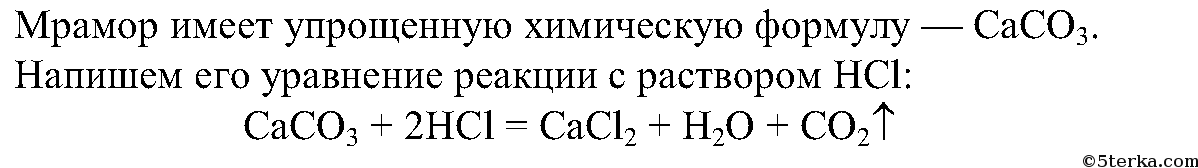
Картонным кружком стакан прикрывают для того, чтобы не улетучивался углекислый газ.
При внесении в стакан с углекислым газом спичка тухнет, т.к. углекислый газ не поддерживает горения. Углекислый газ можно переливать из одного стакан в другой, т.к. он тяжелее воздуха и оседает на дне.

Наблюдается помутнение раствора, на практике это используется при побелке стен. Происходит реакция:
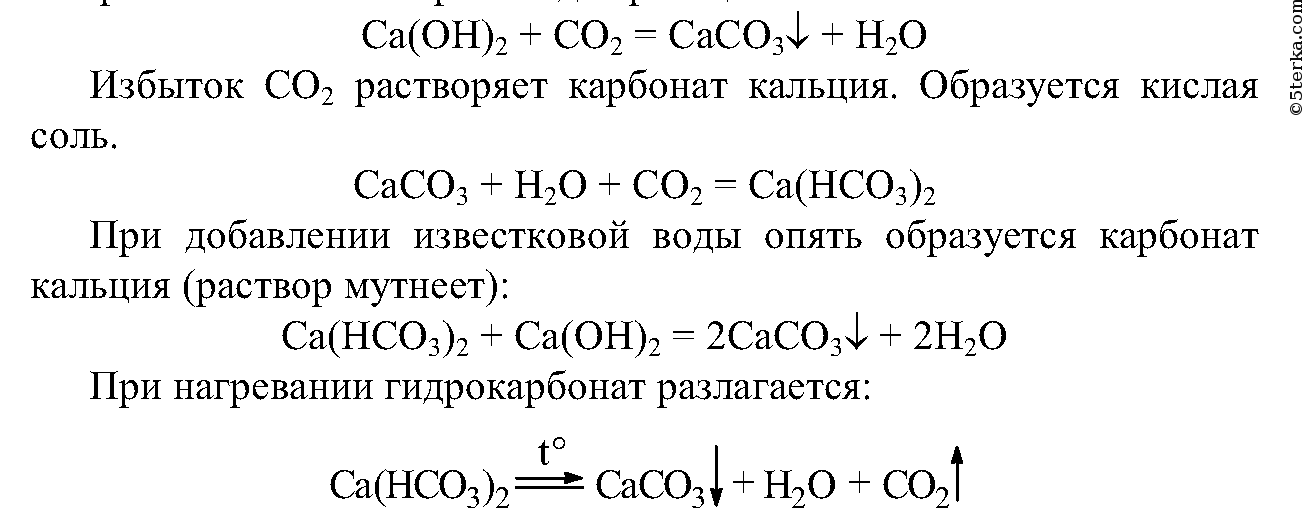
а) карбонаты можно перевести в гидрокарбонаты, пропуская через них углекислый газ;
б) гидрокарбонаты можно перевести в карбонаты нагреванием или добавлением известковой воды.
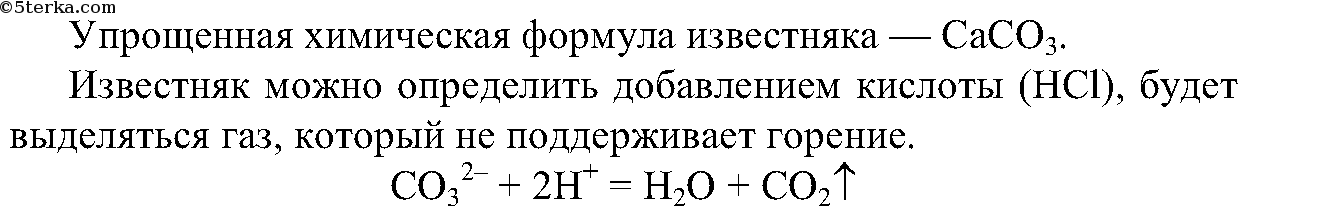
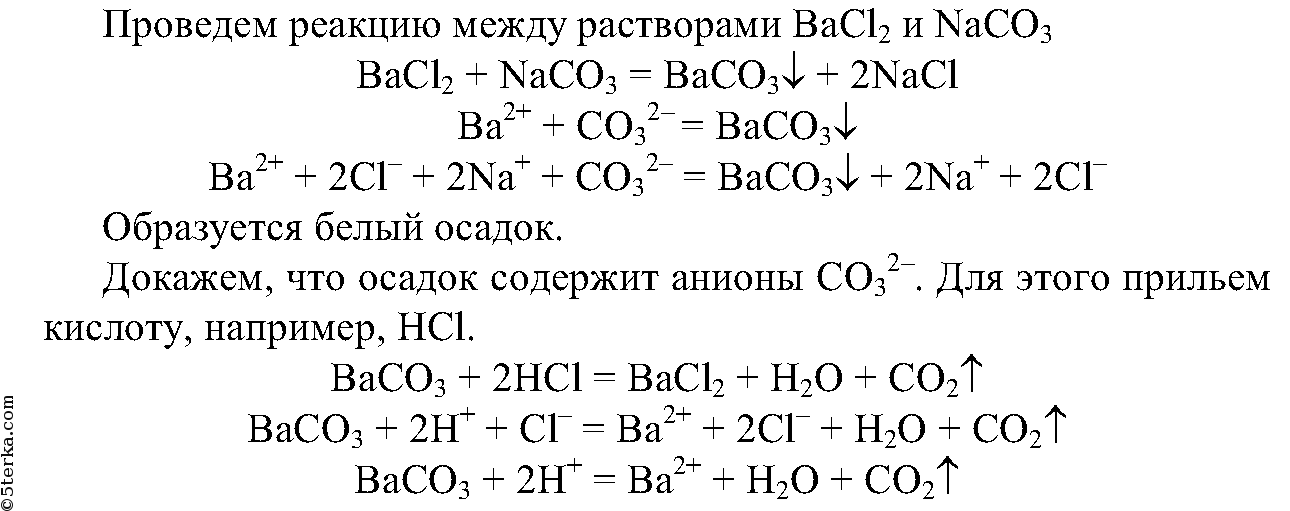
Выделяется газ, который не поддерживает горение.








