Упругость
насыщенных паров углеводородов
характеризует то давление, при котором
газ начинает конденсироваться и
переходить в жидкое состояние. У
индивидуальных углеводородов в чистом
виде упругость паров (Q) есть функция
только температуры: Q =ѓ (Т). Величина
упругости насыщенных паров углеводородов
повышается с ростом температуры, и она
тем выше, чем ниже плотность углеводорода.
Аналогично с ростом молекулярной массы
углеводорода, величина упругости
насыщенный паров углеводородов
уменьшается при равных температурах
(рис. 2.11).
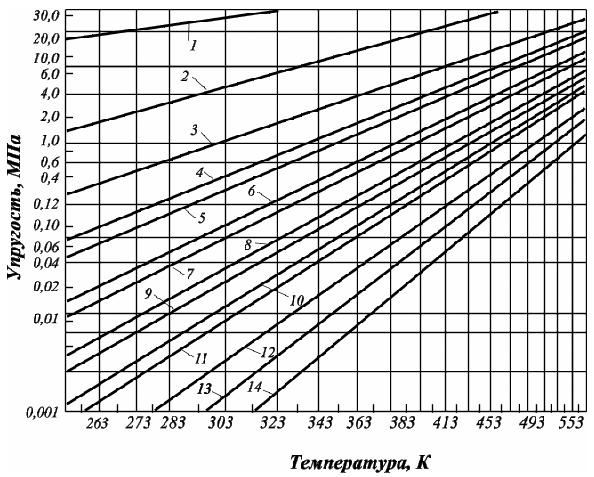
Рис. 2.11. Кривые
упругости насыщенных паров чистых
углеводородов:
10. –
изогептан; 11. –
гептан;
Зависимость
упругости пара от температуры: Q =ѓ (Т) –
нелинейная функция. Для ее линеаризации
шкала упругости пара принята
логарифмической, и это создает удобства
для пересчета величины упругости пара
при нужной температуре. Анализ зависимостей
представленных на рис. 2.11 свидетельствует,
что давление паров метана наибольшее.
При нормальных условиях его нельзя
превратить в жидкость (пунктирная
линия), так как его критическая температура
(Ткр.)
= –
82,4о С
(190,75 К).
На рис. 2.12, а
изображены зависимости объёма жидкого
и парообразного пропана. При сжатии от
точки М до точки А имеется перегретый
(ненасыщенный) пар, зависимость объёма
жидкости от давления при конкретной
температуре имеет гиперболическую
форму.
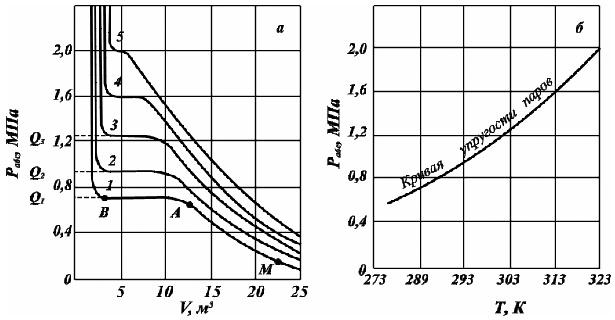
Рис.
2.10. Зависимости давления от объёма и
температуры (а) и кривая упругости
насыщенных паров (б) при температурах,
К: 1. –
283; 2. –
293; 3. –
303; 4. –
313; 5. –
323.
В точке А пар
становится насыщенным, а при дальнейшем
изменении объёма (участок АВ) он постепенно
переходит в жидкость при неизменном
давлении. В точке В заканчивается переход
пара в жидкость. При дальнейшем сжатии
пара будет резко повышаться давление
при почти неизменном объёме. Горизонтальный
участок АВ соответствует неизменности
давления в процессе конденсации паровой
фазы в жидкую фазу. Величина этого
давления и есть упругость насыщенного
пара газового компонента при данной
температуре. Чем ближе значение
температуры, при которой измеряется
упругость насыщенного пара газового
компонента к значению критической
температуре, тем короче горизонтальный
участок. На основе полученных данных
строят кривую упругости насыщенных
паров, представляющую зависимость
давления от от температуры испарения
данной жидкости (рис. 2. 12, б).
У смеси
углеводородов упругость паров является
функцией и температуры и общего давления
смеси: Q = ѓ (Т, Рсм.).
Величина её зависит от упругости паров
отдельных компонентов при данной
температуре и от их мольных концентраций.
Общее давление смеси влияет на упругость
паров каждого компонента и это влияние
учитывается по закону Рауля:
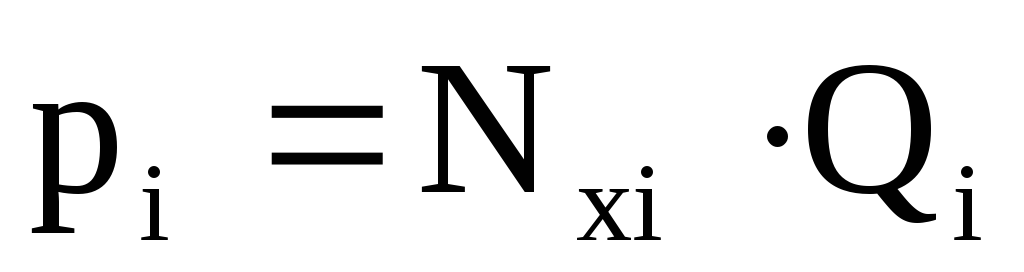
где Р –
общее давление;
рi
–
парциальное давление i-го компонента;
Qi
–
упругость паров i-го компонента;
Nxi
–
мольная доля i-го компонента в жидкости.
Упругость
паров смеси компонентов повышается с
увеличением общего давления. Это влияние
ничтожно при низких давлениях (≈
до 1 МПа), а при высоких давлениях упругость
паров резко увеличивается.
групповой и
вещественный составы нефти.
Основными
элементами
состава нефти
являются углерод (83,5-87%) и водород
(11,5-14 %). Кроме того, в нефти присутствуют:
сера в
количестве от 0,1 до 1-2 % (иногда ее
содержание может доходить до 5-7 %, во
многих нефтях серы практически нет);
азот в
количестве от 0,001 до 1 (иногда до 1,7 %);
кислород
(встречается
не в чистом виде, а в различных соединениях)
в количестве от 0,01 до 1 % и более, но не
превышает 3,6 %.
Фракционный
состав нефти
показывает содержание в ней различных
фракций, выкипающих в определенных
температурных интервалах, и отражает
содержание соединений в них.
Фракцией
называется доля нефти, выкипающая в
определенном интервале температур.
Нефти выкипают в очень широком интервале
температур, в основном, от 28 до 520-540С.
Фракционный состав нефти определяется
стандартным методом (ГОСТ 2177–82)
по результатам лабораторных испытаний
при разделении соединений по температурам
кипения методом фракционирования
(разгонки) нефти, отгона или смеси
соединений на установках АВТ
(атмосферно-вакуумная трубчатка).
Началом
кипения
фракции считают температуру падения
первой капли сконденсированных паров.
Концом
кипения
фракции считают температуру, при которой
испарение фракции прекращается.
Различают
следующие основные фракции нефти:
28-180СС
–
широкая бензиновая фракция;
180-320С
–
широкая керосиновая фракция;
140-340С
–
дизельная топливо (летнее);
180-360С
–
дизельная топливо (зимнее);
350-500С
–
широкая масляная фракция;
Под
групповым
составом нефти
(фракции) понимают количественное
соотношение в ней отдельных групп
углеводородов, гетероатомных соединений.
Нефть
представляет собой сложную смесь
органических соединений (более 1000),
преимущественно углеводородов,
их производных и гетероатомных
соединений.
Углеводороды
представляют
собой органические соединения углерода
и водорода. В нефти в основном содержатся
следующие классы углеводородов.
Парафиновые
углеводороды
(алканы) –
насыщенные (предельные) углеводороды
с общей формулой CnH2n+2.
Содержание их в нефти составляет 30-70 %.
Различают алканы нормального строения
(н-алканы-пентан и его гомологи),
изостроения (изоалканы-изопентан и др.)
и изопреноидного строения (изопрены –
пристан, фитан и др.). В нефти присутствуют
газообразные алканы от С1
до
С4
(в виде растворённого газа), жидкие
алканы С5
–
С16,
составляют основную массу жидких фракций
нефти и твёрдые алканы состава С17
–
С53
и более, которые входят в тяжёлые нефтяные
фракции и известны как парафины.
Нафтеновые
углеводороды
(циклоалканы) –
насыщенные алициклические углеводороды.
К ним относятся моноциклические с общей
формулой CnH2n,
бициклические –
CnH2n-2,
трициклические –
CnH2n-4,
тетрациклические
–
CnH2n-6.
Содержание нафтеновых углеводородов
в нефтях может колебаться от 25 до 75 %. Из
моноциклических углеводородов в нефти
присутствуют в основном пяти- и
шестичленные нафтены. Общее содержание
нафтеновых углеводородов в нефти растёт
по мере увеличения ее молекулярной
массы.
Ароматические
углеводороды (арены)
–
соединения, в молекулах которых
присутствуют циклические углеводороды
с р–сопряжёнными
системами. Содержание их в нефти
изменяется от 10 до 50 %. К ним относятся
представители моноциклических: бензол
и его гомологи (толуол, о-, м-, п-ксилол и
др.), бициклические: нафталин и его
гомологи, трициклические: фенантрен,
антрацен и их гомологи, тетрациклические:
пирен и его гомологи и другие.
Гибридные
углеводороды (церезины) – углеводороды
смешанного строения: парафино–нафтенового,
парафино–ароматического,
нафтено–ароматического.
В основном, это твёрдые алканы с примесью
длинноцепочечных углеводородов,
содержащих циклановое или ароматическое
ядро. Они являются основной составной
частью парафиновых отложений в процессах
добычи и подготовки нефтей.
В
зависимости от преимущественного
содержания в нефти одного или нескольких
классов углеводородов она может
называться парафиновой (парафинового
основания), парафино–нафтеновой,
нафтеновой, нафтено–ароматической,
ароматической
Гетероатомные
соединения –
углеводороды, в состав молекул которых
входят кислород, сера, азот, металлы или
неметаллы. К ним относятся:
Подавляющая
часть гетероатомных соединений содержится
в наиболее высокомолекулярных фракциях
нефти, выкипающих выше 300оС.
В нефтях Западной Сибири на их долю
приходится до 15 %.
В нефти содержатся
в малых количествах минеральные вещества,
вода и механические примеси.
Состав полностью
определяет физико-химические свойства
нефтей. Вследствие изменчивости
химического состава, физико-химические
свойства нефтей различных месторождений
и даже различных пластов одного
месторождения отличаются большим
разнообразием.
- Насыщенный газ
- Добыча нефти вторичными методами
- Испарение, конденсация, кипение. Насыщенные и ненасыщенные пары
- Насыщенный пар
- Давление насыщенного пара над искривлённой поверхностью раздела фазПравить
- ЛитератураПравить
- Насыщенный и ненасыщенный парПравить
- Водяной парПравить
- Некоторые частные случаиПравить
- ЭтимологияПравить
- Физические свойстваПравить
- Сосуществование с жидкостью
- Тепловое движение молекул газа
- Электрический ток в газах
- Упрощённые модели газаПравить
Насыщенный газ
Газообразное
вещество, в присутствии образующей его
жидкости.
Незначительное охлаждение его способно
вызвать конденсацию.
Equipment
used for the removal of entrained liquids and solids from gas,
usually installed upstream from gas compressors.
Скруббер (газоочиститель); скребок;
проволочный ёрш
Установка, служащая
для отделения сопутствующих жидкостей
и твердых компонентов от газа, обычно
устанавливаемая до газовых компрессоров.
Purification of a gas or
liquid by washing it in a contact vessel.
Очистка газа или
жидкости путём промывания в башенном
скруббере.
A
polymer added to drilling mud in order to make a porous formation
impermeable.
Полимер, добавляемый
в буровой раствор для того, чтобы
обеспечить непроницаемость пористой
породы.
Methods
by which the ultimate oil recovery from a reservoir is increased
after production by natural forces has become uneconomical. Methods
used include:
a) Repressurizing by
injection of high-pressure gas
b) Gas drive, i.e. the use of
gas under lower pressure than (a) and
c) Use of water to drive oil
out of the formation.
Добыча нефти вторичными методами
Методы, с помощью
которых остаточная нефть добывается
после эксплуатации на естественных
режимах:
а) закачка газа
высокого давления;
б) газовый режим,
т.е. использование газа под более низким
давлением, чем в п. а);
Rocks laid down by the
accumulation of sediments at the bottom of a sea, lake, river or
swamp.
Породы, образованные
скоплением отложений на дне моря, озера,
реки или болота.
A
technique for determining the detailed structure of the rocks
underlying a particular area by passing acoustic shock waves into
the strata and detecting and measuring the reflected signals.
Техника определения
структуры породы, залегающей в недрах
определённой территории путём подачи
акустических волн через слои горных
пород и измерения отражённых сигналов.
An exploration technique
involving the use of seismic methods (See Seismic survey).
Разведка с
использованием сейсмологических
методов (См. Сейсмическая съёмка).
A floating drilling platform
that is supported by underwater pontoons.
Плавучая буровая
платформа, поддерживаемая подводными
понтонами.
A
series of trays with sieves that vibrate to remove cuttings from the
circulating fluid in rotary drilling operations.
Устройство с
вибрирующими сетками для очистки
бурового раствора от шлама.
A grooved pulley.
Колесо с желобчатым
ободом.
In order to facilitate the
flow of oil towards the well bore explosive charges are sometimes
lowered into the well and fired opposite the producing formation
with a view to fracturing or shattering it.
Для улучшения
притока по направлению к стволу скважины,
в нее иногда опускается заряд и взрывается
на уровне продуктивного пласта, с целью
его разрыва или растрескивания.
An
indication of the presence of gas, oil or water in the formations
penetrated during drilling the exploratory well.
Испарение, конденсация, кипение. Насыщенные и ненасыщенные пары
Любое вещество при
определенных условиях может находиться
в различных агрегатных состояниях –
твердом, жидком и газообразном. Переход
из одного состояния в другое называется
фазовым переходом. Испарение и
конденсация являются примерами
фазовых переходов.
Все реальные газы
(кислород, азот, водород и т. д.) при
определенных условиях способны
превращаться в жидкость. Однако
превращение газа в жидкость может
происходить только при температурах
ниже определенной, так называемой
критической температуры Tкр.
Например, для воды критическая
температура равна 647,3 К, для азота
126 К, для кислорода 154,3 К. При
комнатной температуре (≈ 300 К) вода
может находиться и в жидком, и в
газообразном состояниях, а азот и
кислород существуют только в виде газов.
Испарением называется
фазовый переход из жидкого состояния
в газообразное. С точки зрения
молекулярно-кинетической теории,
испарение – это процесс, при котором с
поверхности жидкости вылетают наиболее
быстрые молекулы, кинетическая энергия
которых превышает энергию их связи с
остальными молекулами жидкости. Это
приводит к уменьшению средней кинетической
энергии оставшихся молекул, то есть к
охлаждению жидкости (если нет подвода
энергии от окружающих тел).
Конденсация – это
процесс, обратный процессу испарения.
При конденсации молекулы пара возвращаются
в жидкость.
В закрытом сосуде
жидкость и ее пар могут находиться в
состоянии динамического равновесия,
когда число молекул, вылетающих из
жидкости, равно числу молекул,
возвращающихся в жидкость из пара, то
есть когда скорости процессов испарения
и конденсации одинаковы. Такую систему
называют двухфазной. Пар, находящийся
в равновесии со своей жидкостью, называют
насыщенным.
Число молекул, вылетающих
с единицы площади поверхности жидкости
за одну секунду, зависит от температуры
жидкости. Число молекул, возвращающихся
из пара в жидкость, зависит от концентрации
молекул пара и от средней скорости их
теплового движения, которая определяется
температурой пара. Отсюда следует, что
для данного вещества концентрация
молекул пара при равновесии жидкости
и ее пара определяется их равновесной
температурой. Установление динамического
равновесия между процессами испарения
и конденсации при повышении температуры
происходит при более высоких концентрациях
молекул пара. Так как давление газа
(пара) определяется его концентрацией
и температурой, то можно сделать вывод:
давление насыщенного пара p0
данного вещества зависит только от его
температуры и не зависит от объема.
Поэтому изотермы реальных газов на
плоскости (p, V) содержат горизонтальные
участки, соответствующие двухфазной
системе (рис. 1.3.11).
Если изотермически
сжимать ненасыщенный пар при T < Tкр,
то его давление будет возрастать, пока
не станет равным давлению насыщенного
пара. При дальнейшем уменьшении объема
на дне сосуда образуется жидкость и
устанавливается динамическое равновесие
между жидкостью и ее насыщенным паром.
С уменьшением объема все большая часть
пара конденсируется, а его давление
остается неизменным (горизонтальный
участок на изотерме). Когда весь пар
превращается в жидкость, давление резко
возрастает при дальнейшем уменьшении
объема вследствие малой сжимаемости
жидкости.
Из газообразного
состояния в жидкое можно перейти, минуя
двухфазную область. Для этого нужно
совершить процесс в обход критической
точки K. Один из возможных процессов
такого рода показан на рис. 3.4.1 ломаной
линией ABC.
В атмосферном воздухе
всегда присутствуют пары воды при
некотором парциальном давлении p,
которое, как правило, меньше давления
насыщенного пара p0. Отношение
p / p0, выраженное в процентах,
называется относительной влажностью
воздуха.
Ненасыщенный пар можно
теоретически описывать с помощью
уравнения состояния идеального газа
при обычных для реальных газов
ограничениях: давление пара должно быть
не слишком велико (практически
p ≤ (106–107) Па), а его
температура выше некоторого определенного
для каждого вещества значения. К
насыщенному пару также можно приближенно
применять законы идеального газа при
условии, что для каждой температуры T
давление p0 насыщенного пара
определяется по кривой равновесия
p0(T) для данного вещества.
Давление p0
насыщенного пара очень быстро возрастает
с ростом температуры T. Зависимость
p0(T) нельзя получить из законов
идеального газа. Давление газа при
постоянной концентрации молекул растет
прямо пропорционально температуре. В
насыщенном паре при повышении температуры
возрастает не только средняя кинетическая
энергия движения молекул, но и их
концентрация. Поэтому давление насыщенного
пара при повышении температуры возрастает
быстрее, чем давление идеального газа
при постоянной концентрации молекул.
Испарение может
происходить не только с поверхности,
но и в объеме жидкости. В жидкости всегда
имеются мельчайшие пузырьки газа. Если
давление насыщенного пара жидкости
равно внешнему давлению (то есть давлению
газа в пузырьках) или превышает его,
жидкость будет испаряться внутрь
пузырьков. Пузырьки, наполненные паром,
расширяются и всплывают на поверхность.
Этот процесс называется кипением.
Таким образом, кипение жидкости
начинается при такой температуре, при
которой давление ее насыщенных паров
становится равным внешнему давлению.
В частности, при
нормальном атмосферном давлении вода
кипит при температуре 100 °С. Это
значит, что при такой температуре
давление насыщенных паров воды равно
1 атм. При подъеме в горы атмосферное
давление уменьшается, и поэтому
температура кипения воды понижается
(приблизительно на 1 °С на каждые 300
метров высоты). На высоте 7 км давление
составляет примерно 0,4 атм, и температура
кипения понижается до 70 °С.
В герметически закрытом
сосуде жидкость кипеть не может, т. к.
при каждом значении температуры
устанавливается равновесие между
жидкостью и ее насыщенным паром. По
кривой равновесия p0(T) можно
определять температуры кипения жидкости
при различных давлениях.
Изображенная на
рис. 3.4.1 картина изотерм реального
газа описывает процессы испарения и
конденсации, то есть фазовый переход
между газообразной и жидкой фазами
вещества. На самом деле эта картина
является неполной, т. к. из газообразного
и жидкого состояний любое вещество
может перейти в твердое состояние. При
заданной температуре T термодинамическое
равновесие между двумя фазами одного
и того же вещества возможно лишь при
определенном значении давления в
системе. Зависимость равновесного
давления от температуры называется
кривой фазового равновесия. Примером
может служить кривая равновесия p0(T)
насыщенного пара и жидкости. Если кривые
равновесия между различными фазами
данного вещества построить на плоскости
(p, T), то они разбивают эту плоскость
на отдельные области, в которых вещество
существует в однородном агрегатном
состоянии – твердом, жидком или
газообразном (рис. 1.3.12). Изображенные
в координатной системе (p, T) кривые
равновесия называются фазовой
диаграммой.
Кривая OT, соответствующая
равновесию между твердой и газообразной
фазами, называется кривой сублимации.
Кривая TK равновесия между жидкостью и
паром называется кривой испарения,
она обрывается в критической точке K.
Кривая TM равновесия между твердым телом
и жидкостью называется кривой плавления.
Кривые равновесия
сходятся в точке T, в которой могут
сосуществовать в равновесии все три
фазы. Эта точка называется тройной
точкой.
Для многих веществ
давление pтр в тройной точке меньше
1 атм ≈ 105 Па. Такие
вещества при нагревании при атмосферном
давлении плавятся. Например, тройная
точка воды имеет координаты Tтр = 273,16 К,
pтр = 6,02·102 Па. Эта
точка используется в качестве опорной
для калибровки абсолютной температурной
шкалы Кельвина (см. §3.2). Существуют,
однако, и такие вещества, у которых pтр
превышает 1 атм. Так для углекислоты
(CO2) давление pтр = 5,11 атм
и температура Tтр = 216,5 К.
Поэтому при атмосферном давлении твердая
углекислота может существовать только
при низкой температуре, а в жидком
состоянии при p = 1 атм она вообще
не существует. В равновесии со своим
паром при атмосферном давлении углекислота
находится при температуре 173 К или
–80 °С в твердом состоянии. Это широко
применяемый «сухой лед», который никогда
не плавится, а только испаряется
(сублимирует).
МЕТОДИКА и ПОРЯДОК
ИЗМЕРЕНИЙ
Внимательно рассмотрите
рисунок и зарисуйте необходимое в свой
конспект лабораторной работы.
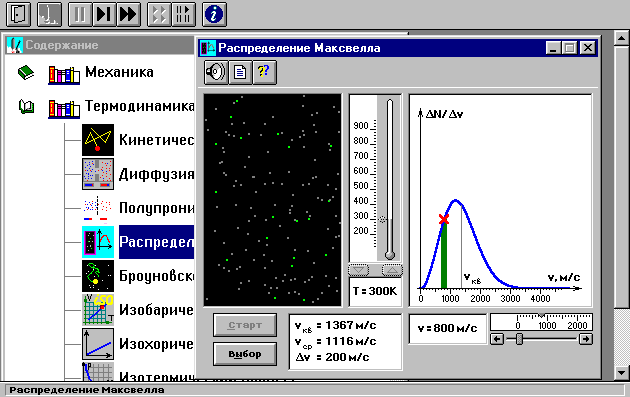
Внимательно рассмотрите
изображение на экране монитора компьютера.
Обратите внимание на систему частиц,
движущихся в замкнутом объеме слева во
внутреннем окне. Они абсолютно упруго
сталкиваются друг с другом и со стенками
сосуда. Их количество около 100 и данная
система является хорошей «механической»
моделью идеального газа. В процессе
исследований можно останавливать
движение всех молекул (при нажатии
кнопки « »
вверху) и получать как бы «мгновенные
фотографии», на которых выделяются
более ярким свечением частицы (точки),
скорости которых лежат в заданном
диапазоне v
вблизи заданной скорости v
(т.е., имеющие скорости от v
до v+v).
Для продолжения наблюдения движения
частиц надо нажать кнопку «».
Запишите в тетрадь значение v,
указанное на экране.
Получите у преподавателя
допуск для выполнения измерений.
- Нажмите кнопки
«», «СТАРТ» и
«ВЫБОР» и установите температуру Т1
, указанную в таблице 1 для вашей бригады.
Запишите для нее значение наивероятнейшей
скорости. - Установите скорость
выделенной группы молекул вблизи
минимального заданного в таблице 2
значения. - Нажмите кнопку
«» и через
10-20 секунд получите еще одну мгновенную
фотографию (нажав кнопку « »).
Подсчитайте количество частиц с заданной
скоростью. Результат запишите в табл.2. - Повторите еще 3
раза измерения для данной скорости и
результаты запишите в табл.2. - Измените скорость
до значения, указанного в табл.2, и
сделайте по 5 измерений (как в пункте
4) для каждой скорости. - Установите (как в
пункте 1) вторую температуру Т2 из
табл.1. Запишите для нее значение
наивероятнейшей скорости. - Повторите измерения
(по пунктам 2,3,4,5), записывая результат
в табл.3, аналогичную табл.2.
ТАБЛИЦА
1. Примерные значения температуры (не
перерисовывать)
ТАБЛИЦЫ 2,3 Результаты измерений при
T = ____ K
ОБРАБОТКА РЕЗУЛЬТАТОВ
И ОФОРМЛЕНИЕ ОТЧЕТА:
- Вычислите и запишите
в таблицы средние значения количества
частиц Nср,
скорости которых лежат в данном диапазоне
от v до v+v. - Постройте на одном
рисунке графики экспериментальных и
теоретических зависимостей Nср(v).
Теоретические зависимости можно
срисовать с экрана монитора компьютера,
подобрав соответствующий масштаб по
вертикальной оси ординат. - Для каждой
температуры определите экспериментальное
значение наивероятнейшей скорости
молекул vвер. - Постройте график
зависимости квадрата наивероятнейшей
скорости от температуры - По данному графику
определите значение массы молекулы
- Подберите газ,
масса молекулы которого достаточно
близка к измеренной массе молекулы. - Запишите ответы
и проанализируйте ответы и графики.
Насыщенный пар
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 25 июня 2022 года; проверки требуют 2 правки.
Испарение и конденсация на границе раздела пар-жидкость. При насыщении пара установлено динамическое равновесие между конденсацией и испарением, при этом в среднем число молекул, влетающих в жидкость, равно числу молекул вылетающих из жидкость в единицу времени.
В таблице приведены значения давления насыщенного пара для некоторых веществ:
Давление насыщенного пара над искривлённой поверхностью раздела фазПравить
Над искривлённой поверхностью раздела фаз давление насыщенного пара отличается от давления насыщенного пара над плоской поверхностью, причём это отличие тем больше, чем меньше главные радиусы кривизны, эти отклонения описываются уравнением Кельвина. Например, давление вокруг сферических капелек жидкости тем больше, чем меньше капельки, поэтому мелкие капельки испаряются быстрее, происходит перенос вещества к крупным каплям и в водяном тумане происходит постепенное укрупнение капель.
Этим же объясняется квазистационарное состояние пересыщенного пара или перегретой жидкости без конденсации или кипения, где возникновении мелких капель или пузырьков пара затруднено без центров конденсации или кипения — твёрдых частиц, ионов.
- РМГ 75-2014. Измерения влажности веществ. Термины и определения, 2015, с. 2.
- Башта Т. М. Давление (упругость) насыщенных паров жидкостей // Машиностроительная гидравлика : справочное пособие. — изд. 2-е, перераб. и доп.. — М.: Машиностроение, 1971. — С. 43—44. — 670 с.
ЛитератураПравить
- Давление насыщенных водяных паров над поверхностью воды в зависимости от температуры (-40—40 °C).
- Давление насыщенных водяных паров над поверхностью льда в зависимости от температуры (-40—0 °C).
- Давление насыщенного водяного пара. Онлайн-калькулятор.
- Калькулятор: Таблица свойств насыщенного пара по температуре. Давление в mmHg abs, удельный объём в m3/kg.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 11 октября 2022 года; проверки требуют 3 правки.
У этого термина существуют и другие значения, см. Пар (значения).
Пар — газообразное состояние вещества в условиях, когда газовая фаза может находиться в равновесии с жидкой или твёрдой фазами того же вещества, то есть при температурах ниже критической температуры вещества. Процесс возникновения пара из жидкой фазы называется парообразованием, из твёрдой — сублимация или возгонка. Обратный процесс называется конденсация; для перехода в твёрдое состояние также используют термин десублимация.
Модель пара над жидкостью. Молекулы вещества вылетают из жидкости в результате испарения (парообразования) и одновременно молекулы из газовой фазы переходят в жидкость в результате конденсации пара.
В разговорной речи под словом пар почти всегда понимают водяной пар. Пары́ прочих веществ оговариваются в явном виде.
У разных жидкостей динамическое равновесие с паром наступает при различной плотности пара. Причина этого заключается в различии сил межмолекулярного взаимодействия. В жидкостях, у которых силы межмолекулярного притяжения велики, например у ртути, только наиболее быстрые молекулы, число которых незначительно, могут вылетать из жидкости. Поэтому для таких жидкостей уже при небольшой плотности пара наступает состояние равновесия. У летучих жидкостей с малой силой притяжения молекул, например у эфира, при той же температуре может вылететь за пределы жидкости множество молекул. Поэтому и равновесное состояние наступает только при значительной плотности пара.

Выброс тумана и его десублимация в иней на Европе в представлении художника
Не следует путать оптически однородный и гомогенный пар с туманом (взвесь мелких капель в газе) — гетерогенной системой, сильно рассеивающей свет.
Насыщенный и ненасыщенный парПравить
Различают следующие виды состояний пара химически чистых веществ:
- Ненасыщенный пар — пар, не достигший динамического равновесия с жидкостью. При данной температуре давление ненасыщенного пара всегда меньше давления насыщенного пара. При наличии над поверхностью жидкости ненасыщенного пара процесс парообразования преобладает над процессом конденсации, и потому количество жидкости в сосуде с течением времени уменьшается.
- Насыщенный пар — пар, находящийся в динамическом равновесии с жидкостью (скорость испарения равна скорости конденсации). Это означает, что при данной температуре в этом объёме не может находиться большее количество пара. Если сжимать пар, находящийся в равновесии с жидкостью под поршнем (при условии, что воздух из сосуда предварительно откачан), то равновесие будет нарушаться. Так как плотность пара в первый момент увеличится, то увеличится конденсация (из пара в жидкость начнет переходить большее количество молекул, чем из жидкости в газ). Этот процесс будет продолжаться до тех пор, пока вновь не установятся динамическое равновесие и плотность пара, а следовательно, и концентрация молекул газа не примет прежнее значение.
Водяной парПравить
Водяной пар — газообразное состояние воды.
Благодаря своим свойствам, водяной пар получил широкое распространение в разнообразной деятельности человека.
- В промышленности является теплоносителем, рабочим телом в паровых машинах и турбинах или очистительным агентом (при паровой очистке).
- Используется в качестве огнетушащего вещества в системах паротушения.
- В кулинарии применяется для приготовления блюд «на пару́», например — паровой рыбы.
- РМГ 75-2014. Измерения влажности веществ. Термины и определения, 2015, с. 2.
- // Физический энциклопедический словарь / Гл. ред. А. М. Прохоров. — М.: Советская энциклопедия, 1984. — С. 529. — 944 с.
- Любитов Ю. Н. // Физическая энциклопедия / Гл. ред. А. М. Прохоров. — М.: Большая Российская энциклопедия, 1992. — Т. 3. — С. 248. — 672 с. — — ISBN 5-85270-019-3.
- Сивухин Д. В. Общий курс физики. — М.: Физматлит, 2005. — Т. II. Термодинамика и молекулярная физика. — С. 384. — 544 с. — ISBN 5-9221-0601-5.
- Савельев И. В.. Курс общей физики. — М.: «Наука», 1970. — Т. I. Механика. Молекулярная физика. — С. 414—415.
У этого термина существуют и другие значения, см. Газ (значения).
Запрос «Газы» перенаправляется сюда; см. также другие значения.

Подобно жидкостям, газы обладают текучестью и сопротивляются деформации. В отличие от жидкостей, газы не имеют фиксированного объёма, а стремятся заполнить весь доступный объём (например, сосуда). В планетарном масштабе газ в атмосфере удерживается гравитацией и не образует свободной поверхности.
Чтобы испарить жидкость, вовсе необязательно её нагревать. Можно уменьшить атмосферное давление поднятием на высоту, либо вакуумированием.
Некоторые частные случаиПравить
- Идеальный газ — газ, в котором взаимодействие между молекулами сводится к парным столкновениям, причём время межмолекулярного столкновения намного меньше среднего времени между столкновениями. Идеальный газ является простейшим модельным объектом молекулярной физики. В классической (феноменологической) термодинамике идеальный газ — гипотетический, не существующий в природе газ, в точности подчиняющийся уравнению газового состояния Клапейрона — Менделеева:
- Газ Ван-дер-Ваальса — идеализированный газ, точно подчиняющийся уравнению Ван-дер-Ваальса. Важнейшим свойством этого газа является существование в такой простой модели фазового перехода газ — жидкость.
- Частично или полностью ионизованный газ называется плазмой (иногда называется следующим агрегатным состоянием).
- Также газом в технике и в быту кратко называют природный газ, основу которого составляет газ метан.
ЭтимологияПравить
Не исключено также воздействие немецкого gasen «кипеть».
В России для обозначения газов М. В. Ломоносов употреблял термин «упругие жидкости», но он не прижился.
Физические свойстваПравить
Большинство газов сложно или невозможно наблюдать непосредственно нашими органами чувств, они описываются с помощью четырёх физических свойств или макроскопических характеристик: давлением, объёмом, количеством частиц (химики используют моль) и температурой. Эти четыре характеристики издавна неоднократно исследовались учёными, такими как Роберт Бойль, Жак Шарль, Джон Дальтон, Гей-Люссак и Амедео Авогадро для различных газов в различных условиях. Их детальное изучение в итоге привело к установлению математической связи между этими свойствами, выраженной в уравнении состояния идеального газа.
Основной особенностью газа является то, что он заполняет всё доступное пространство, не образуя поверхности. Газы всегда смешиваются. Газ — изотропное вещество, то есть его свойства не зависят от направления. В случаях, когда силами тяготения можно пренебречь или они уравновешены другими силами, давление во всех точках газа одинаково (см. Закон Паскаля).
Газ имеет высокую сжимаемость — при увеличении давления возрастает его плотность. При повышении температуры газы расширяются. При сжатии газ может перейти в жидкость, если его температура ниже так называемой критической температуры. Критическая температура является характеристикой конкретного газа и зависит от сил взаимодействия между его молекулами. Так, например, газ гелий можно сжижить только при температуре меньшей, чем 4,2 К.
Существуют газы, которые при охлаждении переходят в твёрдое тело, минуя жидкую фазу. Превращение жидкости в газ называется испарением, а непосредственное превращение твёрдого тела в газ — сублимацией.
Сосуществование с жидкостью
В определённом диапазоне температур и давлений газ и жидкость одного и того же вещества могут сосуществовать в виде равновесной двухфазовой системы. Газ над поверхностью жидкости называют насыщенным паром.
Если бы можно было наблюдать газ под мощным микроскопом, можно было бы увидеть набор частиц (молекул, атомов и т. д.) без определённой формы и объёма, которые находятся в хаотическом движении. Эти нейтральные частицы газа изменяют направление только тогда, когда они сталкиваются с другими частицами или стенками ёмкости. Если предположить, что эти взаимодействия (удары) абсолютно упругие, это вещество превращается из реального в идеальный газ. Эта доля с микроскопической точки зрения газа описывается молекулярно-кинетической теорией. Все предпосылки, лежащие в этой теории, можно найти в разделе «Основные постулаты» кинетической теории.
Тепловое движение молекул газа
Важнейшей чертой теплового движения молекул газа — это беспорядочность (хаотичность) движения. Экспериментальным доказательством непрерывного характера движения молекул является диффузия и броуновское движение.
Диффузия — это явление самопроизвольного проникновения молекул одного вещества в другое. В результате взаимной диффузии веществ происходит постепенное выравнивание их концентрации во всех областях занимаемого ими объёма. Установлено, что скорость протекания процесса диффузии зависит от рода веществ и температуры.
Одним из самых интересных явлений, подтверждающих хаотичность движения молекул, является броуновское движение, которое проявляется в виде теплового движения микроскопических частиц вещества, находящихся в газе во взвешенном состоянии. Это явление в 1827 году впервые наблюдал Р. Броун, от имени которого оно получило название. Беспорядочность перемещения таких частиц объясняется случайным характером передачи импульсов от молекул газа частице с разных сторон. Броуновское движение оказывается тем заметнее, чем меньше частица и чем выше температура системы. Зависимость от температуры свидетельствует о том, что скорость хаотического движения молекул возрастает с увеличением температуры, именно поэтому его и называют тепловым движением.
Закон Авогадро — одинаковые объёмы любых газов при одинаковом давлении и температуре содержат одинаковое число молекул.
Этот закон был открыт на основе опытов по химии итальянским учёным Амедео Авогадро в 1811 году. Закон касается слабо сжатых газов (например, газов под атмосферным давлением). В случае сильно сжатых газов считать его справедливым нельзя. Закон Авогадро означает, что давление газа при определённой температуре зависит только от числа молекул в единице объёма газа, но не зависит от того, какие это молекулы.
Количество вещества, содержащее число граммов, равное его молекулярной массе, называется грамм-молекулой или молем. Из сказанного следует, что моли разных веществ содержат одинаковое число молекул. Число молекул в одном моле вещества, получившее название «число Авогадро», является важной физической величиной. По ГОСТ 3651.2-97, значение постоянной Авогадро принимается:
NA = 6,0221367 · 1023 ± 0,0000036 · 1023 моль−1
Число Авогадро, по данным CODATA−2010, равно
NA = 6,02214129 · 1023 ± 0,00000027 · 1023 моль−1
Для определения постоянной Авогадро были сделаны многочисленные и разнообразные исследования (броуновского движения, явлений электролиза и др.), которые привели к достаточно согласованным результатам и являются ярким свидетельством реальности молекул и молекулярного строения вещества.
Кинетическая теория даёт представление о макроскопических свойствах газов, рассматривая их молекулярное строение и движение молекул. Начиная с определения импульса и кинетической энергии, можно, используя закон сохранения импульса и геометрические зависимости, связать макроскопические свойства системы (температуру и давление) с микроскопическими свойствами (кинетической энергии одной молекулы).
Кинетическая теория объясняет термодинамические явления, исходя из атомистических представлений. Теория постулирует, что тепло является следствием хаотического движения чрезвычайно большого количества микроскопических частиц (атомов и молекул). Теория объясняет, как газовая система реагирует на внешние воздействия. Например, когда газ нагревается от абсолютного нуля, при котором его (классические) частицы абсолютно неподвижны, скорость частиц возрастает с ростом его температуры. Это приводит к большему числу их столкновений со стенками сосуда в единицу времени за счёт более высокой скорости. По мере роста числа столкновений возрастает их воздействие на стенки сосуда, пропорционально которому возрастает давление.
Успешное объяснение газовых законов, исходя из положений кинетической теории, стало одним из факторов подтверждения атомарного строения веществ в природе. В современной физике молекулярно-кинетическая теория рассматривается как составная часть статистической механики.
Электрический ток в газах
Термическая ионизация — придание атомам достаточной кинетической энергии для отрыва электрона от ядра и последующей ионизации вследствие повышения температуры газа и тепловое движение атомов газа, приводящее к столкновениям и превращением их в кинетическую энергию. Температуры, необходимые для ионизации газов, очень высоки (например, для водорода этот показатель составляет 6000 К). Этот тип ионизации газов распространён преимущественно в природе.
При низкой температуре газ также может проводить ток, если мощность его внутреннего электрического поля превышает некоторое пороговое значение. Пороговое значение в этом случае — достижение электроном под действием электрического поля достаточной кинетической энергии, необходимой для ионизации атома. Далее электроны снова разгоняются электрическим полем для ионизации и ионизируют два атома и т. д. — процесс становится цепным. В конечном итоге все свободные электроны достигнут позитивного электрода, позитивные ионы — негативного электрода. Данный тип ионизации распространён преимущественно в промышленности.
При нагревании катода электрическим разрядом с большой силой тока происходит его нагрев до степени термоэлектронной эмиссии электронов из него (дуговой разряд).
Для газа характерен высокий коэффициент самодиффузии.
Газы имеют невысокую теплопроводность, поскольку передача энергии от молекулы к молекуле происходит за счет редких столкновений. Этим объясняются хорошие теплоизоляционные свойства шерсти и ваты, материалов, в которых большинство объёма заполнено воздухом. Но в газах действует другой механизм передачи тепла — конвекция.
Рассчитать коэффициент сжимаемости можно несколькими способами:
- модифицированным методом NX19 мод;
- модифицированным уравнением состояния GERG-91 мод;
- уравнением состояния AGA8-92DC;
- уравнением состояния ВНИЦ СМВ.
Теплоёмкость газа сильно зависит от характера процесса, который с ним протекает. Наиболее часто используются изобарная теплоёмкость и изохорная ; для идеального газа .
Теплопроводность газов — явление направленного переноса тепловой энергии за счёт столкновения частиц газа без переноса вещества.
В отличие от жидкостей, кинематическая вязкость газов с ростом температуры растёт, хотя для динамической вязкости зависимость менее выражена. Также вязкость растёт с давлением.
Число Прандтля (отношение кинематической вязкости к температуропроводности) для газов обычно немного меньше единицы.
Упрощённые модели газаПравить
Под уравнением состояния (для газов) подразумевают математическую модель, которая используется для приближённого описания или моделирования свойств газа. В настоящее время не существует единого уравнения состояния, которое бы точно прогнозировало свойства всех газов при любых условиях. Поэтому было разработано большое число точных уравнений состояния для конкретных газов в диапазоне определённых температур и давлений. Математические модели газа, наиболее часто используемые — это модели «идеального газа» и «реального газа».
Идеальный газ — это газ, в котором молекулы можно считать материальными точками, а силами притяжения и отталкивания между молекулами можно пренебречь. В природе такого газа не существует, но близкими по свойствам к идеальному газу являются реальные разреженные газы при давлениях, не превышающих 200 атмосфер, и не очень низких температурах, поскольку при таких условиях расстояние между молекулами намного превышает их размеры. С точки зрения феноменологической термодинамики идеальным газом (по определению) называется гипотетический, не существующий в природе, газ, в точности подчиняющийся уравнению газового состояния Клапейрона — Менделеева:
Различают три типа идеального газа:
Внутренняя энергия идеального газа описывается следующим уравнением:
является константой (равной, например, 3/2 для одноатомного газа),
— внутренняя энергия (Дж),
— давление (Па),
— объём (м3),
— количество вещества (моль),
— универсальная газовая постоянная (Дж/(моль·К)),
— абсолютная температура (К),
— количество молекул,
— постоянная Больцмана (Дж/К).
Реальный газ — это газ, между молекулами которого действуют силы межмолекулярного взаимодействия.
Силы межмолекулярного взаимодействия — короткодействующие, то есть проявляются на расстояниях R ≤ 10−9 м и быстро уменьшаются с увеличением расстояния.
В 1873 году Ван-дер-Ваальс, проанализировав причины отклонения свойств реальных газов от закона Бойля-Мариотта, вывел уравнение состояния реального газа, в котором были учтены собственный объём молекул и силы взаимодействия между ними. Аналитическое выражение уравнение Ван-дер-Ваальса для одного моля газа имеет вид:
где коэффициенты и называют постоянными Ван дер Ваальса, которые зависят от химической природы вещества, температуры и давления.
Уравнение Ван дер Ваальса для произвольного количества газа массой имеет вид:
Уравнение Ван-дер-Ваальса является приближенным уравнением состояния реального газа, причем степень его приближения различна для разных газов. Записано большое количество эмпирических и полуэмпирических уравнений состояния реальных газов (уравнение: Бертло, Клаузиуса — Клапейрона, Дитеричи, Редлиха — Квонг, Камерлинг-Оннес т. п.). За счет увеличения числа констант в этих уравнениях можно достичь лучшего согласования с практикой, по сравнению с уравнением Ван-дер-Ваальса. Однако уравнение Ван-дер-Ваальса, благодаря своей простоте и физическому содержанию постоянных и входящих в него, является самым распространённым для анализа качественной поведения реальных газов.
- Словарь иностранных слов. — М.: «Русский язык», 1989. — 624 с. ISBN 5-200-00408-8
- Физическая Энциклопедия т. 1, 1988, с. 375.
- Белоконь Н. И., Основные принципы термодинамики, 1968, с. 78.
- Кириллин В. А. , Техническая термодинамика, 1983, с. 165.
- Перельман Я. И. ,Занимательная физика, 1994, с. 109.
- Физическая Энциклопедия т. 1, 1988, с. 123.
- Элементарный учебник ;физики / Под ред. Ландсберг Г. С.. — Изд. 8-е. — М.: Наука, 1972. — Т. 2. — С. 230—268.
- ГОСТ 30319.1-96. Газ природный. Методы расчета физических свойств. Определение физических свойств природного газа, его компонентов и продуктов его переработки.
- Вукалович М. П., Техническая термодинамика, 1968, с. 190—192.
- Физическая Энциклопедия / Гл. ред. А. М. Прохоров. — М.: Советская Энциклопедия, 1988. — Т. 1. — 704 с.
- Белоконь Н. И. Основные принципы термодинамики. — М.: Недра, 1968. — 112 с.
- Вукалович М. П. Техническая термодинамика. — М.: Энергия, 1968. — 496 с.
- Перельман Я. И. Занимательная физика. — Чебоксары: ТОО Арта, 1994. — Т. 2. — 272 с..
- Кириллин В. А. Техническая термодинамика. — 4-е. — М.: Энергоатомиздат, 1983. — 416 с.








