Во́здух — естественная смесь газов, главным образом азота и кислорода, образующая земную атмосферу. Воздух необходим для нормального существования подавляющего числа наземных живых организмов: кислород, содержащийся в воздухе, в процессе дыхания поступает в клетки организма и используется в процессе окисления, в результате которого происходит выделение необходимой для жизни энергии (метаболизм, аэробы). В промышленности и в быту кислород воздуха используется для сжигания топлива с целью получения тепла и механической энергии в двигателях внутреннего сгорания. Из воздуха методом сжижения получают инертные газы. В соответствии с Федеральным Законом «Об охране атмосферного воздуха» под атмосферным воздухом понимается «жизненно важный компонент окружающей среды, представляющий собой естественную смесь газов атмосферы, находящуюся за пределами жилых, производственных и иных помещений».
- Что такое воздух
- Состав воздуха
- Азот
- Кислород
- Что мы узнали?
- Тест по теме
- Оценка доклада
- Физические свойства воздуха
- Какого газа больше всего в атмосфере земли
- Химический состав
- Фенол (C6H5OH)
- Оксид азота (NO)
- Как обезопасить себя от вредных веществ
- Сероводород (H2S)
- Озон (O3)
- Воздух в искусстве
- Аммиак (NH3)
- Свинец (Pb)
- ПДК вредных веществ в атмосферном воздухе
- Двуокись углерода (0,04%)
- Следовые газы в земной атмосфере
- Состав атмосферного и выдыхаемого человеком воздуха
- Аргон (0,93%)
- Азот (78,1%)
- Водяной пар
- Каково распределение газов в атмосфере? Распределение углекислого газа.
- Хлор (Cl2)
- Классы опасности веществ
- Состав вдыхаемого, выдыхаемого и альвеолярного воздуха
- Кислород (20,9%)
- Формальдегид (HCOH)
- Какие газы входят в состав воздуха
- Углекислый газ
- Толуол (C7H8)
- Диоксид азота (NO2)
- Ксилол (C8H10)
- Бензол (C6H6)
- Оксид углерода (СО)
- Диоксид серы (SO2)
Что такое воздух
Итак, атмосферный воздух – это смесь газов, о чем уже было сказано выше. Однако это не полное определение, чтобы расширить его, обратимся к истории. В 1754 году шотландский физик и химик Джозеф Блэк в процессе нагревания белой магнезии обнаружил выделение «связанного воздуха», а именно это был столь популярный в нашем блоге 🙂 углекислый газ в воздухе. Получив СО2, мистер Блэк сделал еще одно очень важное открытие – состав воздуха, до этого считавшегося одним веществом, неоднороден.
Джозеф Блэк фактически показал дорогу другим ученым, которые друг за другом стали все больше расшифровывать состав атмосферы, вычислять кислород в воздухе и другие газы. А затем и сформировалось то самое определение, которое сегодня звучит так: воздух – это смесь газов, образующая атмосферу Земли. Основная функция воздуха – делать планету пригодной для дыхания и существования живых организмов. Для него создан федеральный закон Российской Федерации «Об охране атмосферного воздуха», а также атмосфера является источником инертных газов, которые добываются из воздуха путем сжижения. Итак, из каких газов состоит воздух?
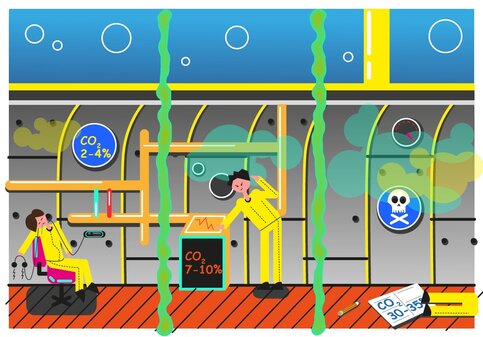
Иллюстрация: Ольга Денисова
Ежеминутно мы делаем около 14 вдохов. Это порядка 840 вдохов в час и 20 160 вдохов сутки. Но что же именно вдыхает человек, и может ли он навредит своим дыханием другим? Об этом мы спросили младшего научного сотрудника Института высшей нервной деятельности и нейрофизиологии РАН Анну Сильченко.
Воздух, которым мы дышим, на 78% состоит из азота, на 21% – из кислорода и на 0,03% – из углекислого газа. Оставшийся процент приходится на водяные пары, водород, благородные газы и другие примеси. С точки зрения физиологии для нас важны только кислород и углекислый газ. Остальные элементы, хоть и растворены в нашей крови, не влияют на жизнедеятельность организма.
В альвеолах легких происходит газообмен: кислород из воздуха растворяется в крови, а углекислый газ, наоборот, выделяется наружу. В итоге в выдыхаемом воздухе содержится примерно 16-17% кислорода и 4% углекислого газа, а также повышается концентрация водяных паров. В проветриваемых помещениях дыхание других людей не представляет для нас опасности.
Другое дело – если вы оказались заперты в подводной лодке со сломанной системой жизнеобеспечения. В таком случае дыхание экипажа будет приводить к постепенному увеличению концентрации углекислого газа. Если воздух на 2-4% состоит из углекислого газа, человек начинает чувствовать сонливость и слабость. Опасной считается концентрация около 7-10%, при которых развиваются удушье, головная боль, происходит потеря сознания. Смертельной считается концентрация 30-35%.
Что касается азота, опасность для нас он представляет только при высоких давлениях – например, глубоко под водой. Азот в высокой концентрации также представляет угрозу при резком уменьшении давления, так как при этом развивается кессонная болезнь.
А.В.Сильченко, младший научный сотрудник Института высшей нервной деятельности и нейрофизиологии РАН, преподаватель образовательного центра для школьников “Improvement”. В образовательном центре ведет группы по физике и математике.
О “Физике города”
Каждый день, просыпаясь утром, мы погружаемся в город, полный фактур, звуков и красок. Пока мы идем на работу и гуляем в парке, нам в голову приходит миллион вопросов о том, как же все вокруг нас устроено в этом огромном мегаполисе. Почему небоскребы не падают? Чем отличается кровь горожанина от крови жителя деревни? Выше какого этажа не стоит жить и почему?
Мы предложили ученым дать ответы на наши вопросы и разъяснить, чем опасно обилие городского освещения, как наше дыхание может навредить окружающим и из-за чего люди болеют зимой. Так появился проект “Физика города”. Новые вопросы и новые ответы ищите на нашем сайте по понедельникам и четвергам.
Состав воздуха

Воздух – смесь газов, необходимых для существования и поддержания жизни на планете. Каковы его особенности, и какие вещества входят в состав воздуха?
Воздух необходим для дыхания всем живым организмам. Он состоит из азота, кислорода, аргона, углекислого газа и ряда примесей. Состав атмосферного воздуха может меняться в зависимости от условий и местности. Так в городской среде уровень углекислого газа в воздухе по сравнению с лесной полосой повышается из-за обилия транспортных средств. В высокогорье концентрация кислорода снижается, так как молекулы азота легче, чем молекулы кислорода. Поэтому концентрация кислорода уменьшается быстрее.
Шотландский физик и химик Джозеф Блэк в 1754 году опытным путем доказал, что воздух – это не просто вещество, а именно газовая смесь

Рис. 1. Джозеф Блэк.
Если говорить о составе воздуха в процентах, то основным его компонентом является азот. Азот занимает 78% от всего объема воздуха. Процентное соотношение кислорода в молекуле воздухе составляет 20,9%. Азот и кислород – 2 основные элемента воздуха. Содержание остальных веществ значительно меньше и не превышает 1%. Так, аргон занимает объем 0,9%, а углекислый газ – 0,03%. Также воздух имеет такие примеси, как неон, криптон, метан, гелий, водород и ксенон.
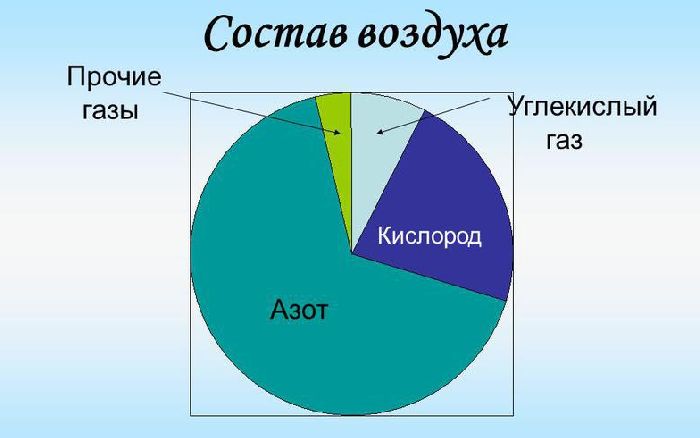
Рис. 2. Состав воздуха.
В производственных помещениях большое значение предают аэроионному составу воздуха. Имеющиеся в воздухе отрицательно заряженные ионы благоприятно влияют на организм человека, заряжают его энергией, повышают настроение.
Азот
Азот – главная составляющая воздуха. Перевод названия элемента – «безжизненный» – может относится к азоту как простому веществу, но азот в связанном состоянии является одним из главных элементов жизни, входит в состав белков, нуклеиновых кислот, витаминов и т. д.
Азот – элемент второго периода, не имеет возбужденных состояний, так как атом не имеет свободных орбиталей. Однако азот способен проявлять в основном состоянии валентность не только III, но и IV за счет образования ковалентной связи по донорно-акцепторному механизму с участием неподеленной электронной пары азота. Степень окисления, которую может проявлять азот, изменяется в широких пределах: от -3 до +5.
В природе азот встречается в виде простого вещества – газа N2 и в связанном состоянии. В молекуле азота атомы связаны прочной тройной связью (энергия связи 940 кДж/моль). При обычной температуре азот может взаимодействовать только с литием. После предварительной активизации молекул путем нагревания, облучения или действием катализаторов азот вступает в реакции с металлами и неметаллами.
Кислород
Кислород – самый распространенный элемент на Земле: массовая доля в земной коре 47,3%, а объемная доля в атмосфере – 20,95%, массовая доля в живых организмах – около 65%.
Практически во всех соединениях (кроме соединений с фтором и пероксидов) кислород проявляет постоянную валентность II и степень окисления – 2. Атом кислорода не имеет возбужденных состояний, так как на втором внешнем уровне нет свободных орбиталей. В качестве простого вещества кислород существует в виде двух аллотропных видоизменений – газов кислорода О2 и озона О3. Самое важное соединение кислорода – это вода. Около 71% земной поверхности занимает водная оболочка, без воды невозможна жизнь.
Озон в природе образуется из кислорода воздуха во время грозовых разрядов, а в лаборатории – пропусканием электрического разряда через кислород.

Рис. 3. Озон.
Озон – еще более сильный окислитель, чем кислород. В частности? он окисляет золото и платину
Кислород в промышленности обычно получают сжижением воздуха с последующим отделением азота за счет его испарения (имеется разница в температурах кипения: – -183 градуса для жидкого кислорода и -196 градусов для жидкого азота.)

Что мы узнали?
Воздух – необходимый элемент для каждого живого существа, значение которого трудно переоценить. Большую часть которого составляет азот и кислород. В химический состав воздуха также входит углекислый газ, аргон, неон, криптон, водород, гелий. В данной статье по химии (8 класс) кратко рассказывается о воздухе в целом, и об его основных элементах.
Тест по теме
Чтобы попасть сюда – пройдите тест.
Оценка доклада
А какая ваша оценка?
Физические свойства воздуха
Как и у всякой смеси веществ, сегодня можно установить физические свойства воздуха.
Каким бы ни был состав воздуха, необходимо стараться исключать из него «химические добавки» от деятельности промышленности и по возможности вдыхать только чистый, свежий, и даже подогретый качественным бризером воздух в городе или первозданный – на природе. В любом случае, воздух – один из самых известных и малопонятных для не специалиста коктейлей, который необходим для жизни. На протяжении всей своей истории человечество неоднократно романтизировало образ воздушной стихии, превознося ее способность проникать сквозь границы и легкость, называя воздух символом свободы.
Дышите чистым и свободным от загрязнений воздухом и будьте здоровы!
Какого газа больше всего в атмосфере земли

Схема состава атмосферы земли.
Некоторые люди удивляются, узнав, что кислород — не самый распространенный газ в составе атмосферы Земли. Судя по относительным объемам газов в атмосфере Земли, азота на самом деле более чем в 3 раза больше, чем кислорода.
В процентном отношении от самого большого до самого малого, химический состав атмосферы Земли содержит азот, кислород, аргон, CO 2 и следовые газы. Водяной пар тоже составляет значительную часть состава атмосферы, но поскольку его количество сильно варьируется географически и в зависимости от сезона, он исключается из этой общей суммы и рассматривается отдельно.
Тропосфера является самым нижним слоем атмосферы, она содержит 75 процентов массы атмосферы.
Химический состав
Воздух всегда содержит пары воды. Так, при температуре 0 °C 1 м³ воздуха может вмещать максимально 5 граммов воды, а при температуре +10 °C — уже 10 граммов.
Фенол (C6H5OH)
Фенол – один из промышленных загрязнителей, который губителен для животных и человека. При вдыхании паров фенола возникает упадок сил, тошнота, головокружение. Фенол негативно влияет на нервную и дыхательные системы, а также на почки, печень и т.д. Использование фенола часто приводит к плачевным последствиям. В семидесятых годах в СССР его использовали при строительстве жилых домов. Люди, жившие в «фенольных домах», жаловались на плохое самочувствие, аллергию, возникновение онкологических заболеваний и на другие недуги. Хотя фенол-формальдегидные смолы используются при изготовлении мебели, строительных материалов и многого другого, недобросовестные производители могут превышать допустимую норму или применять некачественные химикаты.
Оксид азота (NO)
Оксид азота – токсичный бесцветный газ. Он не раздражает дыхательные пути, поэтому человеку сложно его почувствовать. NO взаимодействует с гемоглобином и образует метгемоглобин, который блокирует дыхательные пути и вызывает кислородное голодание. Взаимодействуя с кислородом, газ превращается в диоксид азота (NO2).
Как обезопасить себя от вредных веществ
Экология современного мира такова, что полностью избавиться от вредных веществ мы не можем. Тем не менее в наших силах снизить риск отравления ими к минимуму. Выполняя следующие рекомендации, Вы сможете защитить себя от вредных примесей в воздухе:
- Если окна в Вашем доме выходят на улицу с активным движением автотранспорта либо на промышленное предприятие, помещение необходимо правильно проветривать. Открытые окна, впуская опасные газы, лишь ухудшают «погоду в доме». В такой ситуации поможет бризер: система фильтрации устройства будет очищать воздух от вредных веществ, поступающих с улицы.
- Во время отпуска или на выходных лучше всего выбираться на природу, в места, где есть горы, леса и чистые водоемы. Чистый, свежий воздух благотворно влияет на иммунитет и здоровье.
- Многие считают, что справляться с вредными веществами в воздухе помогают комнатные растения. Но это не совсем так. Хотя они поглощают углекислый газ и некоторые другие вещества, их очистительные способности сильно преувеличены. Если Вы хотите организовать здоровый микроклимат у себя дома, поможет очиститель воздуха.
Дышать чистым воздухом в современном мегаполисе – возможно! Главное – соблюдать меры предосторожности и при появлении подозрительных симптомов обратиться к врачу. Будьте здоровы!
Сероводород (H2S)
Сероводород – бесцветный газ с запахом, напоминающим тухлые яйца. Будучи очень токсичным, H2S воздействует в первую очередь на нервную систему, вызывает сильные головные боли, судороги и может привести к коме. Смертельная концентрация сероводорода составляет примерно 1 000 мг/м3. При концентрации от 6 мг/м3 начинаются головные боли, головокружения и тошнота.
Озон (O3)
Этот газ с характерным запахом, при высоких концентрациях имеющий голубой цвет, защищает нас от ультрафиолетового солнечного излучения. Озон является природным антисептиком, обеззараживает воду и воздух. Еще в пользу озона говорит то, что воздух после грозы, насыщенный озоном, кажется нам свежим и бодрящим. К сожалению, озон вызывает крайне неприятные последствия. Он усугубляет аллергию, обостряет сердечные заболевания, снижает иммунитет и вызывает нарушения дыхания. Озон действует медленно, но крайне губительно в долгосрочной перспективе – особенно опасен данный газ для детей, пожилых людей и астматиков.
Воздух в искусстве
- Фантастический роман Продавец воздуха (1929 год, автор Беляев, Александр Романович) и одноимённая экранизация этого романа.
- Одна из песен группы «Алиса» из альбома «Блок ада» (1987) называется «Воздух».
- Одна из песен группы «Nautilus Pompilius» из альбома «Титаник на Фонтанке» (1993) называется «Воздух».
Аммиак (NH3)
Аммиак – бесцветный газ с резким, едким запахом. Большинству он известен в качестве десятипроцентного водного раствора – нашатырного спирта. Несмотря на то, что вдыхание паров аммиака имеет возбуждающее действие и помогает при обмороках, с этим газом следует быть осторожнее. Аммиак раздражает слизистую оболочку глаз, вызывает удушье, а при высокой концентрации приводит к ожогам роговицы и слепоте, поражает нервную систему вплоть до необратимых изменений, снижает когнитивные функции мозга, провоцирует возникновение галлюцинаций.
Свинец (Pb)
Загрязнение окружающей среды свинцом происходит из-за промышленной деятельности: цветной металлургии, производства аккумуляторов, консервной промышленности. Класс опасности свинца – первый, а значит, он крайне опасен для организма человека. Отравление свинцом проявляется не моментально. Это коварное вещество остается в организме надолго, накапливаясь в костях и тканях. Свинец нарушает функции сердечно-сосудистой и кровеносной систем, слухового аппарата, а также приводит к снижению интеллектуальных способностей. Первые симптомы схожи с признаками сильного переутомления – вялость, головокружение, плохое настроение и т.д. Если своевременно не обратиться к врачу за помощью, симптомы будут только усугубляться. При длительном воздействии свинца на организм у человека появляются судороги, боль в мышцах, дефекты речи. Тяжелое отравление может привести к параличу, коме и смерти.
ПДК вредных веществ в атмосферном воздухе
Что же такое ПДК вредных веществ? ПДК – это предельно допустимая концентрация химических элементов и их соединений в воздухе, которая не вызывает негативных последствий у живых организмов. Нормативы предельно допустимых концентраций вредных веществ утверждаются в законодательном порядке и контролируются санитарно-эпидемиологическими службами (в России – Роспотребнадзором) при помощи токсикологических исследований. ПДК каждого опасного для здоровья вещества входит в ГОСТы, соблюдение которых является обязательным. В случае нарушения норм ПДК каким-либо предприятием на него налагают штраф или вовсе закрывают. Предельно допустимая концентрация устанавливается для людей, которые наиболее подвержены влиянию химикатов (детей, пожилых людей, людей с заболеваниями дыхательной системы и т.д.). Величина ПДК для воздуха измеряется в мг/м3, также предельно допустимая концентрация существует для воды, почвы и продуктов питания.
ПДК вредных веществ в атмосферном воздухе бывает разная:
- ПДКМР – максимальная разовая концентрация вещества. Она не должна влиять на живые организмы в течение 20–30 минут.
- ПДКСС – среднесуточная концентрация. Эта ПДК не должна оказывать отрицательного воздействия на живые организмы в течение неопределенно долгого времени.
Двуокись углерода (0,04%)

Углекислый газ (СО2) — самый важный газ, на который влияет деятельность человека. В свою очередь, углерод, входящий в молекулу СО2 — самый важный элемент для построения молекул, необходимых для жизни живых существ.
Как видно из долгосрочного углеродного цикла, углерод принимает различные формы, такие как двуокись углерода (CO 2), метан (CH 4) и глюкозу (C 6 H 12 O 6).
Сейчас много говорят про парниковый эффект из за большого количества выбросов СО2, но на самом деле общая доля его во всем объёме воздуха совсем незначительная, всего около 0,04%.С 1900 года количество углекислого газа увеличилось в основном из-за деятельности человека. После добычи ископаемого топлива люди сжигают ископаемое топливо.
В свою очередь, такие газы, как метан и углекислый газ, загрязняют атмосферу . Фактически, с 1900 года количество углекислого газа увеличилось почти вдвое.
Следовые газы в земной атмосфере

Остальная часть атмосферы принадлежит следовым газам. Например, неон, гелий, метан. Метан и криптон являются одними из основных газовых примесей, составляющих небольшую часть атмосферы.
Но люди также могут выделять некоторые следовые газы. Например, хлорфторуглероды (ХФУ), разрушающие озоновый слой на северном и южном полюсе.
Когда хлор попадает в тропосферу и, в конечном итоге, в стратосферу, он вступает в реакцию с озоном (O3), существенно его истощая.Подобно озону, водяной пар — это переменный газ.
Состав атмосферного и выдыхаемого человеком воздуха
Состав
воздуха при подъеме вверх на несколько
десятков километров меняется мало,
но так как с высотой воздух разрежается,
то содержание каждого газа в единице
объема уменьшается. В чистом воздухе
лесов, больших парков, у берегов морей
обнаруживается незначительное количество
озона, образующегося в результате
действия ультрафиолетовых лучей
солнца или грозовых разрядов на кислород.
При
дыхании часть кислорода из воздуха
переходит в альвеолах легких в кровь,
а часть двуокиси углерода из крови
выделяется в воздух, находящийся в
альвеолах. В результате выдыхаемый
воздух содержит по сравнению с атмосферным
примерно на 25% меньше кислорода и в 100
раз больше двуокиси углерода (см. табл.
1). Выдыхаемый воздух нагрет до
температуры тела и насыщен водяными
парами.
В
верхних дыхательных путях и в легких
задерживается значительная часть
содержащихся во вдыхаемом воздухе
пыли и микроорганизмов. Если воздух
загрязке:;- вредными газами, то они
переходят в легких в кровь, оказывая
поэтому не только местное, но и общее
действие на организм. Рассмотрим
гигиеническое значение важнейших
составных частей атмосферного воздуха.
Кислород
(02)
— наиболее
важная для человека составная
часть воздуха. Колебания в содержании
кислорода в открытой атмосфере
.незначительны. Если наиболее чистый
воздух у берега моря содержит до
20,99% кислорода, то в наиболее загрязненном
воздухе промышленных центров содержание
кислорода составляет не менее 20,7% •
Даже в плохо вентилируемых жилых и
общественных помещениях содержание
кислорода не падает ниже 20% вследствие
диффузии его в помещение через стены
зданий.
Подобные
колебания содержания кислорода в воздухе
не оказывают заметного влияния на
человеческий организм. Физиологические
сдвиги наблюдаются лишь в том- случае
если содержание кислорода в воздухе
падает до 17—16%;
при 11 —13% кислорода отмечается выраженная
кислородная недостаточность, ведущая
к резкому снижению работоспособности;
при 7—8% кислорода в воздухе может
наступить смерть.
Кислородная
недостаточность, которая возможна при
полетах (высотная болезнь) и при
восхождении на горы (горная болезнь),
начинается на высоте около 3 км..
Низкая
концентрация кислорода может иметь
место в
воздухе замкнутых пространств и
герметически закрытых помещений,
например в подводных лодках при аварии,
а также в рудниках, шахтах и заброшенных
колодцах, где кислород может быть
вытеснен другими газами. Предупредить
действие недостатка кислорода можно с
помощью индивидуальных кислородных
приборов, которые позволяют либо
обогащать вдыхаемый воздух кислородом,
либо дышать чистым кислородом.
Подводные лодки и герметические кабины
некоторых высотных самолетов оборудуются
аппаратурой, поглощающей из воздуха
двуокись углерода и водяные пары и
добавляющей к нему кислород.
Для
предупреждения горной болезни большое
значение имеет постепенная акклиматизация
(приспособление) к условиям разреженной
атмосферы. При длительном пребывании
в горах в крови увеличивается количество
гемоглобина и эритроцитов, а окислительные
процессы в тканях протекают более
полно, что позволяет человеку
приспосабливаться к жизни на все
больших высотах. Имеются горные селения,
расположенные на высоте 3—5 км над
уровнем моря (Тибетский район). В то же
время следует учитывать, что лица,
потерявшие много крови или резко
ослабленные, могут испытывать недостаток
кислорода и на высоте, меньшей 2 км;
поэтому при перевозке их санитарным
самолетом следует лететь на небольшой
высоте или давать им дышать кислородом.
Двуокись
углерода (С02)—бесцветный газ, не
имеющий запаха. Он не раздражает слизистые
оболочки и даже при большом содержании
в воздухе не обнаруживается, что
может способствовать отравлению.
Двуокись углерода в 11/г раза
тяжелее воздуха и поэтому может
накапливаться в нижней части замкнутых
пространств.
Вне
населенных пунктов в атмосферном воздухе
содержится 0,03—0,04%’ двуокиси углерода;
в промышленных центрах содержание ее
возрастает до 0,06%. В воздухе жилых
помещений источником двуокиси углерода
являются выдыхаемый людьми воздух,
горящие керосиновые лампы, газовые
горелки и т. п. Однако даже в воздухе
плохо вентилируемых и плотно заселенных
жилых и общественных помещений содержание
двуокиси углерода обычно не превышает
1%. Подобные концентрации двуокиси
углерода, встречающиеся в воздухе
открытой атмосферы или жилых и общественных
зданий, сами по себе не оказывают
заметного влияния на человеческий
организм. Физиологические сдвиги в виде
учащения и углубления дыхания наблюдаются
лишь тогда, когда концентрация двуокиси
углерода в воздухе достигает 2—3%; при
4—5% появляются признаки отравления,
а при 10—12%’ наблюдались случаи быстрой
потери сознания и смерти.
Описаны
случаи отравления двуокисью углерода
в замкнутых
и герметически
закрытых помещениях (шахты, рудники,
подводные лодки), а также в пространствах,
где имело место интенсивное разложение
органических веществ: в силосных ямах,
в хранилищах квашеных овощей, при
опускании людей в канализационные
каналы, в бродильные чаны пивоваренных
заводов, в глубокие колодцы и т. п. Для
предупреждения отравлений необходимо
принимать меры, чтобы содержание двуокиси
углерода в воздухе герметически
закрытых помещений не превышало 1 % –
Рабочие должны быть осведомлены о
возможности образования двуокиси
углерода при разложении или брожении
органических веществ и принимать меры
предосторожности при работе в перечисленных
выше объектах (предварительное опускание
животного; при спуске рабочего привязывание
к веревке; использование кислородного
прибора).
Азот
и другие инертные газы составляют около
79% атмосферного воздуха. При нормальном
давлении они физиологически
недеятельны; их значение заключается
лишь в разбавлении кислорода.
Аргон (0,93%)

Как инертный газ, аргон не связывается с атмосферой и не влияет на нее. Да и в процентном соотношении ко всей земной атмосфере аргона всего 0,93%. Вот почему нет цикла аргона. Но у нас есть азот и углерод из-за их способности связываться с другими элементами.
Азот (78,1%)

Азот — газ, преобладающий в атмосфере земли. Его содержание 78,1%. Хотя азот является наиболее распространенным газом в атмосфере Земли, он составляет всего 0,005% массы земной коры.
Азот невероятно стабилен и требует много энергии для изменения формы.
Несмотря на то, что его объем в земной коре относительно невелик, азот играет важную роль в азотном цикле. В рамках этого цикла азот постоянно обменивается между атмосферой и живыми организмами.
Водяной пар

Движение водяного пара в атмосфере.
Водяной пар был удален из 100% общего количества из-за его региональной изменчивости. Но он может составлять большую часть атмосферы. Например, он может составлять 5% по объему в жарких регионах, но намного меньше в более холодных местностях.
Водяной пар регулирует температуру воздуха, поскольку он поглощает солнечное излучение. Он испаряется из океанов, озер и рек с поверхности Земли. Попадая в атмосферу, водяной пар конденсируется, например, в виде дождя. Он просто меняет форму с газообразного состояния на жидкость.
В рамках гидрологического цикла вода всегда находится в движении. И все это движется солнечной энергией.
Основное внимание уделяется тому, как хранится вода — в атмосфере, ледниках, океанах, растениях и людях. Большая часть испарения происходит в океанах. Это эффект Кориолиса, который перемещает ее в сторону от экватора.
Каково распределение газов в атмосфере? Распределение углекислого газа.
В северном полушарии мы видим самые высокие концентрации углекислого газа из основных источников выбросов. Например, выбросы углерода в основном сосредоточены в Северной Америке, Европе и Азии. Но газ рассеивается, находя свой путь циркуляции в зависимости от погодных условий и океанских течений.
Даже сезонные колебания на Земле влияют на количество углекислого газа в атмосфере. Во время фотосинтеза весной и летом растения поглощают значительное количество углекислого газа из атмосферы.
Когда лето переходит в осень, фотосинтез начинает снижаться, поскольку углекислый газ накапливается обратно в атмосферу. Этот эффект связан с метаболизмом Земли или чистой первичной продуктивностью.
Хлор (Cl2)
Хлор в виде газа имеет желто-зеленый цвет и острый раздражающий запах. Одни из первых симптомов отравления хлором – покраснение глаз, приступы кашля, боль в груди, повышение температуры тела. Возможно развитие бронхопневмонии, бронхита. Будучи сильным канцерогеном, хлор провоцирует возникновение раковых опухолей и туберкулеза. При высокой концентрации летальный исход может наступить после нескольких вдохов.
Классы опасности веществ
По степени воздействия на организм вредные вещества подразделяются на четыре класса опасности. Для каждого класса опасности установлена своя ПДК. Выделяют следующие классы опасности веществ в атмосферном воздухе:
- вещества чрезвычайно опасные (ПДК менее 0,1 мг/м3);
- вещества высокоопасные (ПДК 0,1–1 мг/м3);
- вещества умеренно опасные (ПДК 1,1–10 мг/м3);
- вещества малоопасные (ПДК более 10 мг/м3).
Также существует классификация вредных веществ по эффекту воздействия на живой организм. При этом некоторые вещества относятся сразу к нескольким классам:
- Общетоксические – вещества, вызывающие отравление организма в целом. При их воздействии наблюдаются судороги, расстройства нервной системы, паралич.
- Раздражающие – вещества, поражающие кожу, слизистую оболочку дыхательных путей, легких, глаз, носоглотки. Длительное воздействие приводит к нарушениям дыхания, интоксикации и летальному исходу.
- Сенсибилизаторы – химикаты, вызывающие аллергическую реакцию.
- Канцерогены – одна из самых опасных групп веществ, провоцирующая возникновение онкологических заболеваний.
- Мутагены – вещества, изменяющие генотип человека. Они снижают сопротивляемость организма к заболеваниям, вызывают раннее старение и могут сказаться на здоровье потомства.
- Влияющие на репродуктивное здоровье – вещества, вызывающие отклонения в развитии у потомства (необязательно в первом поколении).
Ниже приведена таблица ПДК некоторых вредных веществ в атмосферном воздухе, установленной в Российской Федерации:
Состав вдыхаемого, выдыхаемого и альвеолярного воздуха
Альвеолярный
и выдыхаемый воздух по своему составу
значительно отличаются друг от друга.
Отличие их состава связано с тем, что
при выдохе к альвеолярному воздуху
примешивается воздух,
который находится в воздухоносных
путях, в так называемом вредном
пространстве. Следовательно,
выдыхаемый воздух представляет собой
смесь альвеолярного воздуха и воздуха
вредного
пространства. Если считать, что человек
в среднем выдыхает (при одном выдохе)
500 мл, то этот
воздух будет состоять из 360 мл альвеолярного
воздуха и 140 мл воздуха, находившегося
во вредном
пространстве.
Переход газов в
легких из воздуха в кровь и, наоборот,
поступление газов из крови в воздух
“одчиняется определенным физическим
законам, связанным с парциальным
давлением и коэффициентами растворимости
газов в жидкостях.
Каждый
газ растворяется в жидкости в зависимости
от своего парциального давления. Что
же называется парциальным давлением
газа? Если имеется смесь газов, то
парциальное давление
каждого газа определяется процентным
содержанием данного газа в смеси газов.
Таким образом,
парциальным
давлением называется та часть общего
давления, которая приходится на долю
каждого
газа в газовой смеси. Поясним это
примером. В состав атмосферного воздуха
входят кислород,
углекислый газ и азот, причем, как нам
известно, кислорода содержится 20,94%,
углекислого
газа 0,03% и азота 79,03%. Каково же будет
парциальное давление каждого из этих
газов? Атмосферное
давление равно 760 мм рт. ст. Следовательно,
если воздух оказывает давление, равное
760 мм, то парциальное давление кислорода
будет равняться 20,94% от общего давления,
т. е. от
760 мм, и будет равно 159 мм рт. ст; парциальное
давление азота составит 79,03% атмосферного
давления
и будет равно 600,8 мм рт. ст. Углекислого
газа содержится очень мало — всего
0,03%. Поэтому
и парциальное давление углекислого
газа будет составлять приблизительно
0,2 мм рт. ст. Если
парциальное давление газа в окружающей
среде выше, чем давление (напряжение)
этого же газа
в жидкости, то газ растворяется в
жидкости, и между жидкостью и окружающим
ее газом устанавливается
определенное равновесие. Напряжение
газа измеряют парциальным давлением
газа над жидкостью, с которой он находится
в равновесии. Если, например, парциальное
давление
кислорода в альвеолярном воздухе будет
выше, чем в притекающей венозной крови,
то кислород
из альвеолярного воздуха будет переходить
в кровь. Но в силу той же разницы газ из
жидкости
будет выходить в окружающий воздух,
когда напряжение газа в жидкости выше,
чем его парциальное
давление в окружающей среде. Если
напряжение углекислого газа в венозной
крови будет
выше, чем его парциальное давление в
альвеолярном воздухе, то этот газ будет
выходить из венозной
крови в альвеолярный воздух. Переход
газа из жидкости в окружающую смесь
газов будет
продолжаться до тех пор, пока не
установится равновесие. Таким образом,
газ растворяется
в
жидкости или выходит из жидкости в
окружающую среду в зависимости от
величины парциального
давления этого же газа в воздухе и его
напряжения в жидкости, причем газ
переходит из среды,
где имеется высокое давление, в среду
с меньшим давлением. Этот переход
продолжается до
тех пор, пока не установится равновесие.
Кроме
парциального давления, при растворении
газов в жидкостях большое значение
имеют температура
жидкости и коэффициент растворимости
газа в жидкости. Между температурой
жидкости
и количеством растворенного в ней газа
существует определенная зависимость:
чем выше
температура жидкости, тем меньше газа
в ней растворяется. Общеизвестно, что
при кипячении
воды из нее выделяются пузырьки
растворенного в ней воздуха. Коэффициентом
растворимости называется то количество
газа, которое может быть растворено в
1 мл воды при давлении 760 мм рт. ст. при
данной температуре. Коэффициент
растворимости меняется в зависимости
от температуры
раствора. Разные газы имеют разный
коэффициент растворимости, так же как
и в разных растворителях может раствориться
разное количество одного и того же газа.
Переход
газов в легких из воздуха в кровь и,
наоборот, поступление газов из крови в
воздух подчиняются
рассмотренным выше физическим законам.
Однако в легких имеется ряд особенностей.
Воздух, находящийся в альвеолах, и кровь,
протекающая по капиллярам, отделены
друг от друга
всего лишь двумя слоями клеток: стенкой
альвеолы и стенкой капилляра. Незначительная
толщина
перепонки, отделяющей газ от крови, не
мешает свободному переходу газа. Полный
газообмен
между альвеолярным воздухом и кровью
возможен в короткий срок протекания
крови по
легочным капиллярам в том случае, если
имеются условия для лучшего и быстрого
перехода газов.
Одним из таких условий является большая
площадь легких. Действительно, если
растянуть
легкие, то их поверхность равняется в
среднем 90 м2.
Вся огромная площадь легкого густо
покрыта
капиллярами, по которым кровь растекается
очень небольшим слоем. Огромная площадь
соприкосновения крови и воздуха при
незначительной толщине слоя протекающей
в капиллярах
крови способствует быстрому насыщению
крови кислородом и отдаче углекислоты.
Газообмен
совершается в легких между альвеолярным
воздухом и кровью. Обмен газов в легких
может протекать
совершенно нормально, так как имеется
вполне достаточная разность в напряжении
газов
в крови и их парциальном давлении в
воздухе. Эта разность видна из табл.
5.2.
Парциальное
давление кислорода, углекислого газа
и азота во вдыхаемом и
альвеолярном воздухе, а также их
напряжение в крови
Кислород
из альвеолярного воздуха в кровь, а
углекислый газ из крови в альвеолярный
воздух
переходят путем диффузии. Диффузия
возможна потому, что парциальное давление
кислорода
в альвеолярном воздухе составляет 110
мм рт. ст., а в венозной крови — 40 мм рт.
ст. Таким образом, создается
разность давления в 70 мм рт. ст., чего
вполне достаточно, чтобы обеспечить
переход кислорода. Потребность человека
в кислороде равна 350 мл в минуту; при
работе потребность в кислороде
возрастает и доходит до 5000 мл в минуту.
Разности в парциальном давлении в 1 мм
рт. ст.
достаточно, чтобы за минуту перешло в
кровь 250 мл кислорода, а между парциальным
давлением
крови в альвеолярном воздухе и его
напряжением в крови имеется разность
в 70
мм рт. ст. — разность, вполне достаточная
для обеспечения максимальных потребностей
организма.
Что же касается углекислого газа, то и
здесь имеется достаточная разность
между напряжением СО2
в крови и его парциальным давлением в
альвеолярном воздухе. Эта разность
равна 6—7
мм рт. ст., что обеспечивает переход
углекислого газа из крови в альвеолярный
воздух.
Связывание,
перенос и отдача кислорода, а также
связывание и перенос углекислоты в
организме
человека осуществляются кровью. Кислород
и углекислый газ находятся в крови в
физически
растворенном состоянии (растворение
газов в жидкости называется абсорбцией)
и в химически
связанном виде. Из 100 мл крови можно
выделить только 20 мл кислорода; между
тем в физически
растворенном состоянии в 100 мл крови
может находиться только 0,3 мл кислорода.
Так как количество кислорода, содержащегося
в 100 мл крови, во много раз больше, чем
может находиться
в растворенном состоянии, то ясно, что
кислород в основном находится в химически
связанном
виде. Веществом, вступающим в химическую
связь с кислородом, является гемоглобин,
содержащийся
в эритроцитах (см. главу 6). Кислород из
воздуха диффундирует в плазму крови, а
из
плазмы поступает в эритроциты и вступает
в химическую связь с гемоглобином.
Гемоглобин при
этом превращается в оксигемоглобин; 1
г гемоглобина может связать 1,34 мл
кислорода. Превращение
гемоглобина в оксигемоглобин, т. е
степень насыщения гемоглобина кислородом,
связано
с величиной парциального давления
кислорода, но зависимость эта не прямо
пропорциональная.
Гемоглобин обладает особым свойством,
имеющим очень важное биологическое
значение: он может
энергично вступать в соединение с
кислородом даже при его незначительном
парциальном давлении.
Артериальная
кровь, насыщенная в легких кислородом,
идет в капиллярную сеть большого круга
кровообращения, где оксигемоглобин
отдает тканям кислород. Оксигемоглобин,
отдавший кислород,
называется восстановленным гемоглобином
(дезоксигемоглобином). В артериальной
крови
почти весь гемоглобин превращен в
оксигемоглобин, а в венозной крови,
оттекающей от капилляров
большого круга кровообращения (см. главу
6), преобладает дезоксигемоглобин. В
переходе кислорода из крови к тканям
решающее значение имеет разность
напряжений кислорода
в артериальной крови и в тканях. Кислород
из крови поступает в тканевую жидкость
и из нее в клетки, где принимает участие
в окислительных процессах. Это возможно
потому, что напряжение кислорода,
растворенного в артериальной крови,
протекающей через капилляры, равно 100—
НО
мм рт. ст., в тканевой жидкости — 20—40 мм
рт. ст., а в клетках свободного кислорода
нет. Разность
напряжения растворенного кислорода,
равная 70—80 мм рт. ст., обеспечивает
энергичный
переход кислорода из плазмы крови в
тканевую жидкость. Оксигемоглобин,
который является нестойким соединением,
отдает кислород в плазму; в силу разности
напряжения растворенный кислород
переходит в тканевую жидкость и оттуда
в клетку, где вступает в окислительные
процессы.
Помимо разности в напряжении растворенного
кислорода, на степень отдачи кислорода
оксигемоглобином
сильно влияет величина напряжения
углекислого газа, растворенного в
крови.
Специальными исследованиями доказано,
что чем выше напряжение углекислого
газа, растворенного в крови, тем
слабее становится связь гемоглобина с
кислородом, т. е. тем больше кислорода
освобождается. В капиллярах большого
круга кровообращения наряду с переходом
кислорода
из крови в тканевую жидкость происходит
и переход углекислого газа из тканевой
жидкости
в кровь. Количество углекислого газа
растет и его напряжение в крови возрастает,
а это обстоятельство
вызывает ослабление связи гемоглобина
с кислородом и способствует большему
освобождению
кислорода. В легких же происходит отдача
углекислого газа; его напряжение в крови
падает и благодаря этому сродство
гемоглобина с кислородом повышается,
т. е. гемоглобин начинает
более энергично соединяться с кислородом
и превращаться в оксигемоглобин. На
прочность
связи гемоглобина с кислородом влияет
также температура. При повышенной
температуре связь ослабевает, при
пониженной — увеличивается.
Связывание
и перенос углекислоты также осуществляет
кровь. Углекислота находится в крови
преимущественно в виде бикарбонатов
натрия и калия. Кроме этих солей, в
переносе углекислого
газа участвует и гемоглобин. Для
поступления углекислого газа в кровь
и перехода из крови в альвеолярный
воздух требуется наличие разности его
давления. В тканевой жидкости напряжение
углекислого газа составляет около 60 мм
рт. ст., а в артериальной крови 40 мм рт.
ст. Следовательно,
имеется достаточная разность, и углекислый
газ диффундирует в кровь. В венозной
крови его
напряжение составляет 47 мм рт. ст., а его
парциальное давление в альвеолярном
воздухе — 40
мм рт. ст. Такая разность давлений вполне
достаточна для перехода углекислого
газа в альвеолярный воздух, а оттуда
— в атмосферный воздух.
Итак,
мы кратко рассмотрели основы
функционирования дыхательной системы
человека, одной
из физиологических систем, изменения
динамики которых в ходе полиграфной
проверки регистрирует
и анализирует специалист-полиграфолог.
Мы
констатировали, что в регуляции
респираторной активности организма
человека принимают
участие нервная и сердечно-сосудистая
системы. Поэтому в следующей главе мы
изложим основы анатомии и физиологии
сердечно-сосудистой системы, еще одной
системы, активность
которой регистрирует и анализирует
полиграфолог в ходе инструментальной
«детекции лжи».
Кислород (20,9%)

Сколько кислорода в атмосфере Земли? Кислород занимает второе место и составляет примерно пятую часть от всего объема атмосферы, если точнее – 20,9%. На Земле есть условия для процветания жизни. Кислород необходим для жизни человека, поскольку наши легкие вдыхают кислород и используют его в обмене веществ.
Хотя азот является чрезвычайно стабильным газом, его сложно разделить и использовать в химических процессах. Кислород легко принимает участие в химических реакциях, потому что он является основным участником всех окислительных процессов.
Таким образом, несмотря на то, что азота много, нам нужен кислород, чтобы управлять химическими реакциями, производящими энергию.
Формальдегид (HCOH)
Содержание формальдегида в воздухе особенно повышено в больших городах, поскольку он является продуктом горения топлива автотранспорта. Также выбросы формальдегида происходят на химических, кожевенных и деревообрабатывающих предприятиях. Он отрицательно воздействует на генетический материал, репродуктивную и дыхательную системы, печень, почки. Отравление начинается с возрастающего поражения нервной системы – с головокружения, чувства страха, дрожи, неровной походки и т.д. Формальдегид официально признан канцерогеном, однако также обладает аллергенным, мутагенным и сенсибилизирующим действием.
Какие газы входят в состав воздуха
Оговоримся сразу, азот в воздухе занимает большую часть, однако и химический состав оставшейся доли весьма интересен и разнообразен. Если коротко, то список основных элементов выглядит следующим образом.
Однако дадим и небольшие пояснения по функциям этих химических элементов.
Содержание азота в воздухе – 78% по объему и 75% по массе, то есть этот элемент доминирует в атмосфере, имеет звание одного из самых распространенных на Земле, и, кроме того, содержится и за пределами зоны обитания человека – на Уране, Нептуне и в межзвездных пространствах. Итак, сколько азота в воздухе, мы уже разобрались, остался вопрос о его функции. Азот необходим для существования живых существ, он входит в состав:
В среднем около 2% живой клетки составляют как раз атомы азота, что объясняет, зачем столько азота в воздухе в процентах объема и массы. Азот также является одним из инертных газов, добываемых из атмосферного воздуха. Из него синтезируют аммиак, используют для охлаждения и в других целях.
Содержание кислорода в воздухе – один из самых популярных вопросов. Сохраняя интригу, отвлечемся на один забавный факт: кислород открыли дважды – в 1771 и 1774 годах, однако из-за разницы в публикациях открытия, почести открытия элемента достались английскому химику Джозефу Пристли, который фактически выделил кислород вторым. Итак, доля кислорода в воздухе колеблется около 21% по объему и 23% по массе. Вместе с азотом эти два газа образуют 99% всего земного воздуха. Однако процент кислорода в воздухе меньше, чем азота, и при этом мы не испытываем проблем с дыханием. Дело в том, что количество кислорода в воздухе оптимально рассчитано именно для нормального дыхания, в чистом виде этот газ действует на организм подобно яду, приводит к затруднениям в работе нервной системы, сбоям дыхания и кровообращения. При этом недостаток кислорода также негативно сказывается на здоровье, вызывая кислородное голодание и все связанные с ним неприятные симптомы. Поэтому сколько кислорода в воздухе содержится, столько и нужно для здорового полноценного дыхания.
Аргон в воздухе занимает третье место, он не имеет запаха, цвета и вкуса. Значимой биологической роли этого газа не выявлено, однако он обладает наркотическим эффектом и даже считается допингом. Добытый из атмосферы аргон используют в промышленности, медицине, для создания искусственной атмосферы, химического синтеза, пожаротушения, создания лазеров и пр.
Углекислый газ
Углекислый газ составляет атмосферу Венеры и Марса, его процент в земном воздухе куда ниже. При этом огромное количество углекислоты содержится в океане, он регулярно поставляется всеми дышащими организмами, выбрасывается за счет работы промышленности. В жизни человека углекислый газ используется в пожаротушении, пищевой промышленности как газ и как пищевая добавка Е290 – консервант и разрыхлитель. В твердом виде углекислота – один из самых известных хладагентов «сухой лед».
Тот самый загадочный свет дискотечных фонарей, яркие вывески и современные фары используют пятый по распространенности химический элемент, который также вдыхает человек – неон. Как и многие инертные газы, неон оказывает на человека наркотическое действие при определенном давлении, однако именно этот газ используют в подготовке водолазов и других людей, работающих при повышенном давлении. Также неоново-гелиевые смеси используются в медицине при расстройствах дыхания, сам неон используют для охлаждения, в производстве сигнальных огней и тех самых неоновых ламп. Однако, вопреки стереотипу, неоновый свет не синий, а красный. Все остальные цвета дают лампы с другими газами.
Метан и воздух имеют очень древнюю историю: в первичной атмосфере, еще до появления человека, метан был в куда большем количестве. Сейчас этот газ, добываемый и используемый как топливо и сырье в производстве, не так широко распространен в атмосфере, но по-прежнему выделяется из Земли. Современные исследования устанавливают роль метана в дыхании и жизнедеятельности организма человека, однако авторитетных данных на этот счет пока нет.
Посмотрев, сколько гелия в воздухе, любой поймет, что этот газ не относится к числу первостепенных по важности. Действительно, сложно определить биологическое значение этого газа. Не считая забавного искажения голоса при вдыхании гелия из шарика 🙂 Однако гелий широко применяется в промышленности: в металлургии, пищевой промышленности, для наполнения воздухоплавающих судов и метеорологических зондов, в лазерах, ядерных реакторах и т.д.
Речь не идет о родине Супермена 🙂 Криптон – инертный газ, который в три раза тяжелее воздуха, химически инертен, добывается из воздуха, используется в лампах накаливания, лазерах и все еще активно изучается. Из интересных свойств криптона стоит отметить, что при давлении в 3,5 атмосферы он оказывает наркотический эффект на человека, а при 6 атмосферах приобретает резкий запах.
Водород в воздухе занимает 0,00005% по объему и 0,00008% по массе, но при этом именно он – самый распространенный элемент во Вселенной. О его истории, производстве и применении вполне можно написать отдельную статью, поэтому сейчас ограничимся небольшим списком отраслей: химическая, топливная, пищевая промышленности, авиация, метеорология, электроэнергетика.
Последний в составе воздуха, изначально и вовсе считавшийся только примесью к криптону. Его название переводится как «чужой», а процент содержания и на Земле, и за ее пределами минимальный, что обусловило его высокую стоимость. Сейчас без ксенона не обходятся: производство мощных и импульсных источников света, диагностика и наркоз в медицине, двигатели космических аппаратов, ракетное топливо. Кроме того, при вдыхании ксенон значительно понижает голос (обратный эффект гелию), а с недавнего времени вдыхание этого газа причислено к списку допингов.
Толуол (C7H8)
Толуол проникает в организм человека не только через органы дыхания, но и через кожу. Симптомы отравления толуолом – раздражение слизистой оболочки глаз, заторможенность, нарушения работы вестибулярного аппарата, галлюцинации. Также толуол крайне пожароопасен и обладает наркотическим воздействием. До 1998 года он входил в состав клея «Момент» и до сих пор содержится в некоторых растворителях для лаков и красок.
Диоксид азота (NO2)
Диоксид азота – ядовитый газ красно-бурого цвета с характерным острым запахом. Образуется он в результате сгорания автомобильного топлива, деятельности ТЭЦ и промышленных предприятий. На начальном этапе воздействия диоксид азота нарушает работу верхних дыхательных путей, а впоследствии способен вызвать бронхит, воспаление или отек легких. Наиболее опасен этот газ для людей, страдающих бронхиальной астмой и другими легочными заболеваниями. Из-за цвета диоксида азота его выбросы называют «лисьим хвостом». С лисой этот газ связывает не только цвет, но еще и хитрость: чтобы «спрятаться» от людей, он ухудшает обоняние и зрение, поэтому его не так-то просто обнаружить.
Ксилол (C8H10)
Ксилол относится к третьему классу опасности, он способен вызвать острые и хронические поражения кроветворных органов. Ксилол – это жидкость без цвета, но с характерным запахом, которая применяется как органический растворитель для изготовления пластмассы, лаков, красок, строительного клея. В малых концентрациях ксилол никак не вредит человеку, однако при длительном вдыхании паров ксилола появляется наркотическая зависимость. Также ксилол поражает нервную систему, вызывает раздражение кожного покрова и слизистой глаз.
Бензол (C6H6)
Бензол – опасный канцероген. При отравлениях парами бензола у человека наблюдается головная боль, тошнота, перепады настроения, нарушения сердечного ритма, иногда – обмороки. Постоянное воздействие бензола на организм проявляется усталостью, расстройством сна, нарушениями функций костного мозга, лейкозом, анемией. Зачастую первый признак отравления бензолом – эйфория, так как вдыхание его паров имеет наркотический эффект. Данное химическое соединение входит в состав бензина, используется для производства пластмасс, красителей, синтетической резины.
Оксид углерода (СО)
Еще одно название оксида углерода, угарный газ, знакомо нам с малых лет. Он часто встречается в быту – например, СО выделяется из-за неисправностей газовых колонок и кухонных плит. Для отравления этим газом нужна совсем небольшая его концентрация. У оксида углерода нет цвета и запаха, что делает его еще опаснее. Интоксикация происходит стремительно, человек может потерять сознание в считанные секунды. Несмотря на то, что класс опасности оксида углерода – четвертый, его воздействие приводит к летальному исходу буквально за несколько минут. Почувствовав трудности с дыханием, головную боль, отсутствие концентрации, снижение слуха и зрения, необходимо по возможности открыть все окна и двери и как можно быстрее покинуть помещение.
Диоксид серы (SO2)
Диоксид серы, или сернистый газ, отличается характерным запахом, похожим на запах горящей спички. Вдыхание SO2 даже в небольшой концентрации может привести к воспалению дыхательных путей, вызвать кашель, насморк и хрипоту. Длительное воздействие провоцирует возникновение дефектов речи, чувства нехватки воздуха, отека легких. Также возможно поражение легочной ткани, но оно проявляется только спустя несколько дней после воздействия. Люди с заболеваниями дыхательной системы, например астматики, наиболее тяжело переносят влияние SO2.








