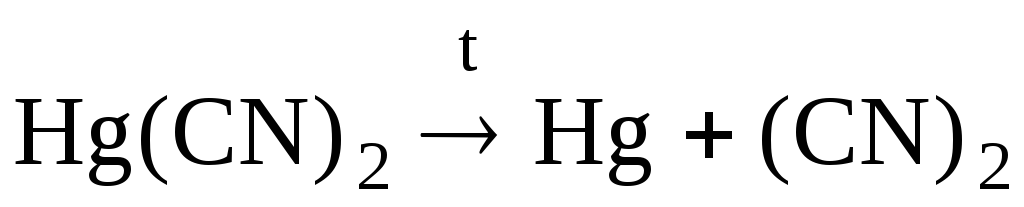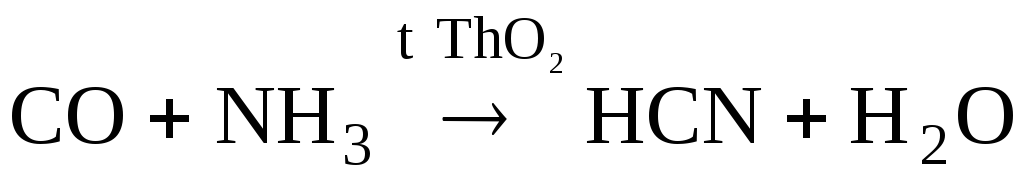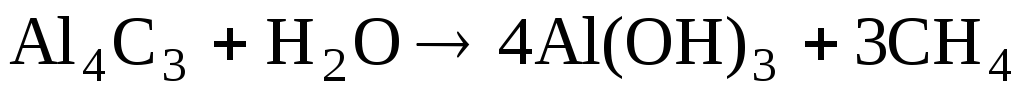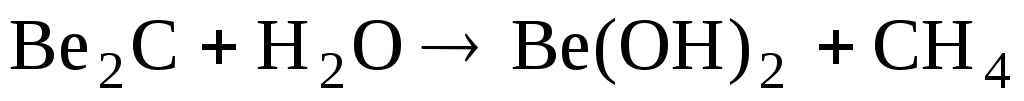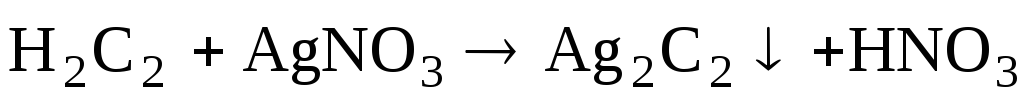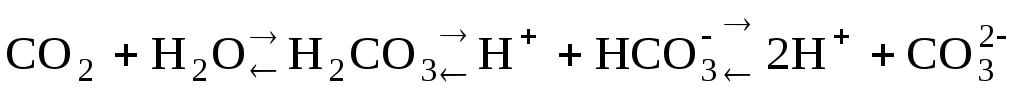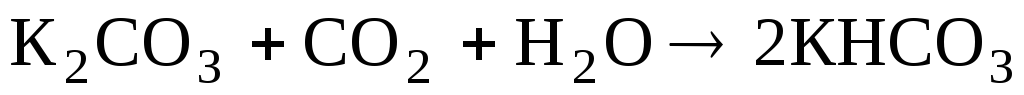В
молекуле СО2
sp-гибридизация
атома углерода. Две sp-гибридные
орбитали образуют 2 -связи
с атомами кислорода, а оставшиеся
негибридизованными р-орбитали углерода
дают с двумя р-орбиталями атомов кислорода
-связи,
которые располагаются в плоскостях
перпендикулярных друг другу.
О
═ С ═ О
Под
давлением 60 атм. и комнатной температуре
СО2
сгущается в бесцветную жидкость. При
сильном охлаждении жидкая СО2
застывает в белую снегоподобную массу,
возгоняющуюся при Р = 1 атм и t
= 195К(-78).
Спрессованная твердая масса называется
сухим льдом, СО2
не поддерживает горения. В нем горят
лишь вещества, у которых сродство к
кислороду выше чем у углерода: например,
2Mg
+ CO2
2MgO
+ C.
СО2
реагирует с NH3:
В лаборатории
(в аппарате Киппа):
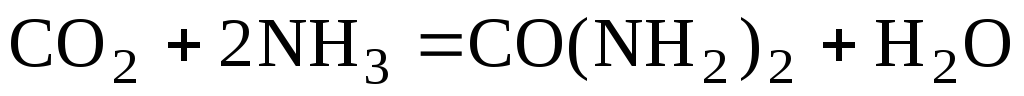
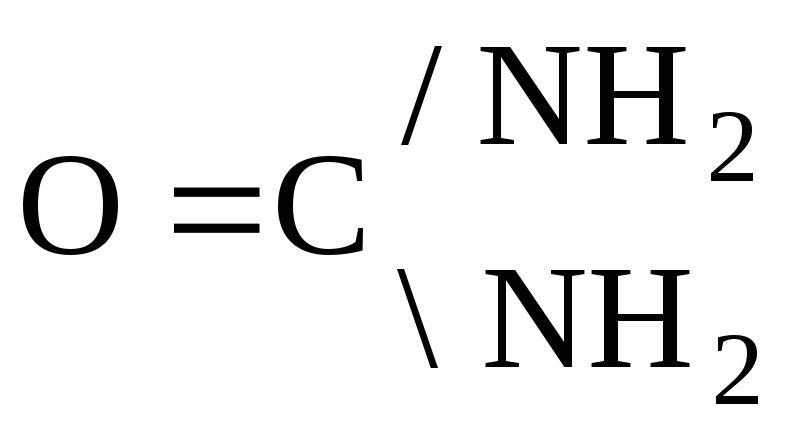

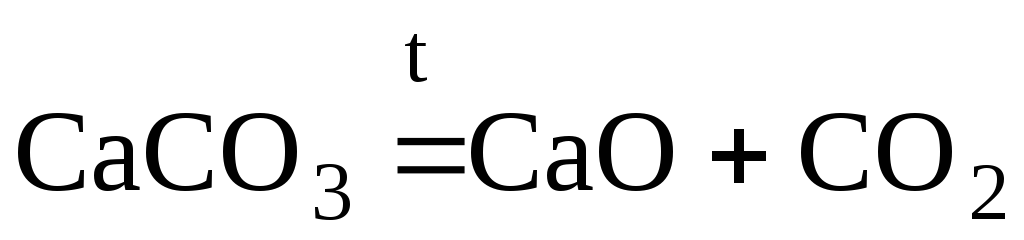
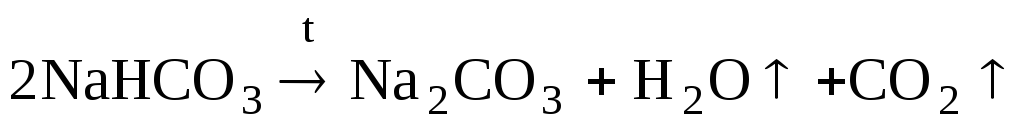
Углерод и его соединения
П
л а н
1.
Положение в таблице Д.И.Менделеева,
строение атома.

2.
Краткая история открытия и происхождение
названия.
3.
Физические свойства. Аллотропные
модификации углерода.
5.
Нахождение в природе.
6.
Основные методы получения.
7.
Важнейшие соединения углерода (угарный
газ, углекислый газ, угольная кислота
и ее соли).
Углерод
находится в главной подгруппе IV группы
периодической системы химических
элементов. Электронная формула атома
углерода имеет вид 1s22s2p2,
это р-элемент,
проявляющий неметаллические свойства.
В невозбужденном состоянии углерод
проявляет валентность II, при переходе
в возбужденное состояние – IV.
Характерные степени окисления в
соединениях –4, +2, +4, например:
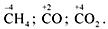
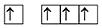
Характерной
особенностью углерода является его
способность к образованию углерод-углеродных
цепей, что обуславливает существование
органических молекул. Для органических
соединений понятие степени окисления
является очень условным, например:
Русское
название углерода означает “рождающий
уголь”. Латинское название carboneum также
означает “уголь”.
Ф
и з и ч е с к и е с в о й с т в а
Химический
элемент углерод в
виде простого вещества образует несколько
аллотропных модификаций.
Алмаз –
аллотропная модификация углерода,
существующая в природе и полученная
искусственным путем. По внешнему виду
это прозрачные кристаллы высокой
твердости. После обработки природных
алмазов получают драгоценный камень –
бриллиант. Кристаллическая решетка
алмаза имеет тетраэдрическое строение,
расстояние между всеми атомами углерода
одинаковое, что обусловлено
ихsp3-гибридизацией.
В кристаллической решетке алмаза
отсутствуют свободные электроны, поэтому
алмаз не проводит электрического тока.
Химическая активность алмаза ниже
активности другой аллотропной модификации
углерода – графита.
Графит –
мягкое темно-серое вещество с металлическим
блеском, жирное на ощупь. Графит легко
измельчается (порошок графита называется
сажей). Кристаллическая решетка графита
имеет слоистое строение и состоит из
слоев правильных шестиугольников,
конденсированных по всем сторонам.
Атомы углерода в графите находятся в
состоянии sp2-гибридизации.
В образовании химических связей участвуют
три электрона атома углерода, а четвертый
электрон остается относительно свободным,
что обеспечивает высокую электропроводность
графита.
Карбин –
аллотропная модификация углерода, очень
редко встречающаяся в природе. Это
полимер, состоящий из линейных
макромолекул, атомы углерода находятся
в состоянии sp-гибридизации.
Карбин – прозрачное и бесцветное
вещество, полупроводник. В химическом
отношении менее активен, чем графит.
Широкого применения не имеет.
Фуллерен –
порошок темного цвета (после очистки
перекристаллизацией – желтые
кристаллы), полупроводник. В природе
эта аллотропная модификация углерода
не встречается, получена искусственным
путем, в настоящее время изучаются
свойства фуллерена. Состоит из молекул
состава С60 или
С70,
атомы углерода находятся в
состоянии sp2-гибридизации.
Объемная молекула фуллерена имеет
полициклическое строение, по внешнему
виду напоминает футбольный мяч.
Х
и м и ч е с к и е с в о й с т в а
В
химическом отношении углерод при обычных
условиях малоактивен, но при нагревании
реагирует со многими простыми и сложными
веществами. В реакциях углерод может
быть как восстановителем, так и
окислителем.
Ag,
Au, Pt +
С
+ Н2О
(г. )
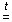
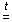
CaO
+ 3C (кокс)
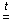
С
+ 4HNO3 (конц.)
= CO2 +
4NO2 +
2H2O,
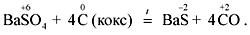
В
природе углерод встречается как в виде
простого вещества (см. аллотропные
модификации), так и в виде соединений,
важнейшими из которых являются: мел,
мрамор, известняк (CaCO3),
доломит (CaCO3•MgCO3)
и др. В атмосфере углерод содержится в
виде угарного и углекислого газов.
Соединения углерода – основные
компоненты природного топлива. Кроме
того, все органические соединения
являются соединениями углерода.
В
а ж н е й ш и е с о е д и н е н и я у г л
е р о д а
Оксид
углерода(II), или угарный газ (СО). Газ
без цвета, вкуса и запаха, легче воздуха,
плохо растворим в воде, токсичен.
Термически устойчив. Атомы в молекуле
угарного газа связаны двумя видами
ковалентной связи: ковалентной полярной
и донорно-акцепторной (кислород является
донором, углерод – акцептором):
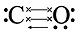
По
химическим свойствам угарный газ
является несолеобразующим оксидом,
химически достаточно пассивен. При
повышенной температуре оксид углерода(II)
взаимодействует с кислородом и оксидами
металлов, являясь сильным восстановителем,
например:
CO
+ MgO Mg
+ CO2.
При
пропускании смеси угарного газа и хлора
через слой активированного угля можно
получить ядовитый газ фосген (химическое
оружие, вызывает паралич дыхательных
путей):
При
нагревании монооксида углерода с
водородом в присутствии катализатора
при повышенном давлении образуется
метиловый спирт:
При
пропускании угарного газа через расплав
щелочи при высоком давлении образуется
соль муравьиной кислоты, поэтому
формально монооксид углерода можно
рассматривать как ангидрид муравьиной
кислоты:
CO
+ KOH (расплав)
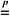
Лабораторный
метод получения угарного газа –
разложение муравьиной кислоты при
нагревании в присутствии дегидратирующего
агента:
Оксид
углерода(IV), или углекислый газ (СО2). Газ
без цвета, вкуса и запаха, тяжелее
воздуха, растворим в воде (88 объемов
углекислого газа в 100 объемах воды), не
поддерживает горения и дыхания (правда,
в атмосфере углекислого газа могут
гореть некоторые активные металлы,
отнимая кислород, например магний):
В
молекуле CO2 атом
углерода образует две

-связи
c атомами кислорода. В образовании
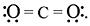
В
химическом отношении диоксид углерода
проявляет все свойства кислотного
оксида:
CO2 +
2NaOH = Na2CO3 +
H2O
CO2 +
NaOH = NaHCO3.
Качественная
реакция на углекислый газ –
пропускание его через известковую или
баритовую воду:
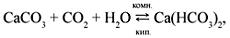
Углекислый
газ можно получить разложением известняка:
действием
на карбонаты металлов растворами сильных
минеральных кислот:
CaCO3 +
2HCl = CaCl2 +
H2O
+ CO2,
при
полном сжигании кокса:
Угольная
кислота (H2CO3) и
ее соли. Угольная
кислота – слабая двухосновная
кислота, в свободном виде не получена,
существует только в растворе. Молекула
имеет полярное строение, атомы углерода
вsp2-гибридизации.
Термически неустойчива, проявляет все
свойства, характерные для слабых кислот
(даже органические кислоты вытесняют
угольную из ее солей):
Угольная
кислота, как двухосновная, образует два
типа солей: карбонаты и гидрокарбонаты:

Все
карбонаты, кроме карбонатов щелочных
металлов, разлагаются при нагревании,
например:
Качественной
реакцией на
карбонаты и гидрокарбонаты является
их взаимодействие с растворами сильных
минеральных кислот, например:
Na2CO3 +
2HCl = NaCl + H2O
+ CO2,
NaHCO3 +
HCl = NaCl + H2O
+ CO2.
Угольная кислота и ее соли
Растворяясь
в воде, углекислый газ частично
взаимодействует с ней, образуя угольную
кислоту H2CO3;
при этом устанавливаются равновесия:
К1
= 410-7
К2
= 4,810-11
– слабая, неустойчивая, кислородсодержащая,
двухосновная кислота. Гидрокарбонаты
растворимы в Н2О.
Карбонаты нерастворимы в воде, кроме
карбонатов щелочных металлов, Li2CO3
и (NH4)2CO3.
Кислые соли угольной кислоты получают,
пропуская избыток СО2
в водный раствор карбоната:
либо
постепенным (по каплям) добавлением
сильной кислоты в избыток водного
раствора карбоната:
Na2CO3
+ HNO3
NaHCO3
+ NaNO3
При
взаимодействии со щелочами или нагревании
(прокаливании) кислые соли переходят в
средние:
Соли гидролизуются
по уравнению:
I ступень
Из-за
полного гидролиза из водных растворов
нельзя выделить карбонаты Gr3+,
Al3+,
Ti4+,
Zr4+
и др.
Практическое
значение имеют соли – Na2CO3
(сода), CaCO3
(мел, мрамор, известняк), K2CO3
(поташ), NaHCO3
(питьевая
сода), Са(НСО3)2
и Mg(HCO3)2
обусловливают карбонатную жесткость
воды.
Сероуглерод (cs2)
При
нагревании (750-1000С)
углерод реагирует с серой, образуя
сероуглерод,
органический растворитель (бесцветная
летучая жидкость, реакционноспособное
вещество), огнеопасен и летуч.
Пары
CS2
– ядовиты,
применяется для фумигации (окуривания)
зернохранилищ против насекомых –
вредителей, в ветеринарии служит для
лечения аскаридоза лошадей. В технике
– растворитель смол, жиров, йода.
С
сульфидами металлов CS2
образует соли тиоугольной кислоты –
тиокарбонаты.
Эта
реакция аналогична процессу
Тиокарбонаты
– желтые кристаллические вещества. При
действии на них кислот выделяется
свободная тиоугольная кислота.
Она
более стабильна чем Н2СО3
и при низкой температуре выделяется из
раствора в виде желтой маслянистой
жидкости, легко разлагающейся на:
Соединения
углерода с азотом (СN)2
или С2N2
– дициан,
легко воспламеняющийся бесцветный газ.
Чистый сухой дициан получают путем
нагревания сулемы с цианидом ртути
(II).
HgCl2
+ Hg(CN)2
Hg2Cl2
+ (С
N)2
4HCNг
+ О2
2(CN)2
+2H2O
2HCNг
+ Сl2
(CN)2
+ 2HCl
Дициан
по свойствам похож на галогены в
молекулярной форме X2.
Так в щелочной среде он, подобно галогенам,
диспропорционирует:
(С
N)2
+ 2NaOH = NaCN + NaOCN
Циановодород
– НСN
(
),
ковалентное соединение, газ, растворяющийся
в воде с образованием синильной кислоты
(бесцветная жидкость и ее соли чрезвычайно
ядовиты). Получают:
Циановодород
получают в промышленности по
каталитическим реакциям.
Соли
синильной кислоты – цианиды, подвержены
сильному гидролизу. CN-
– ион изоэлектронный молекуле СО, входит
как лиганд в большое число комплексов
d-элементов.
Обращение с
цианидами требует строгого соблюдения
мер предосторожности. В сельском
хозяйстве применяют для борьбы с особо
опасными насекомыми – вредителями.
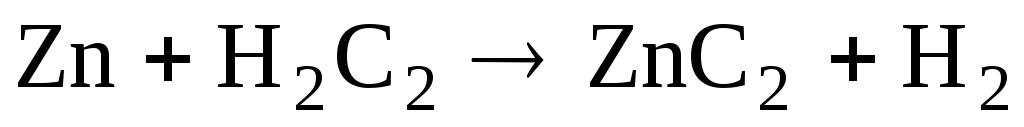
Соединения
углерода с отрицательной степенью
окисления:
Ионноковалентные
разлагаются водой с выделением газа, в
зависимости от того какой выделяется
газ, их делят на:
Металлические
карбиды – соединения стехиометрического
состава образованные элементами 4, 7,8
групп посредством внедрения атомов Ме
в кристаллическую решетку углерода.
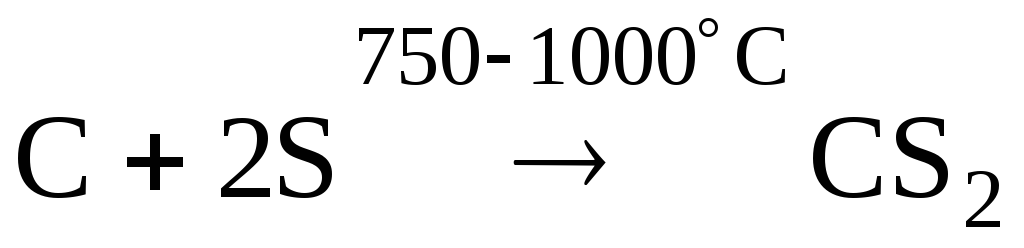
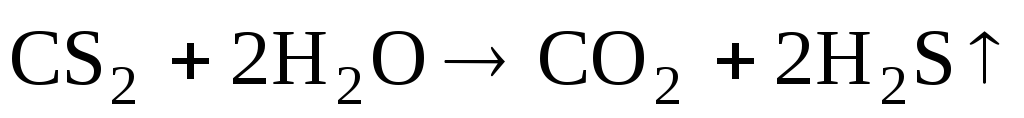
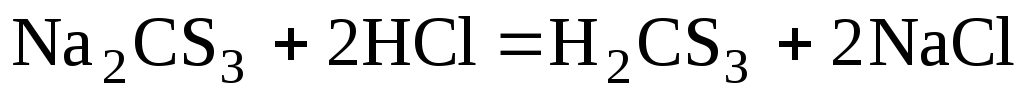
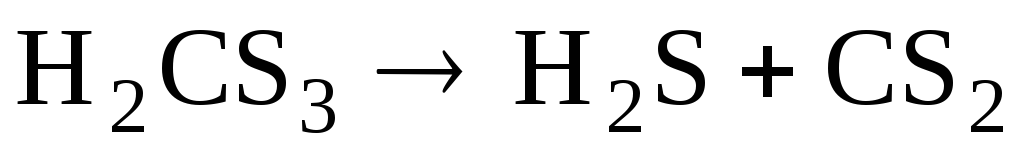
4HCNг
+ О2
2(CN)2
+2H2O
2HCNг
+ Сl2
(CN)2
+ 2HCl