Многие вещества, которые нас окружают, мы можем определить по их специфическим признакам и свойствам. Например, алюминий несложно отличить от других металлов. Он легче, также легко изменяет свою форму, при трении о бумагу или белую ткань оставляет серую полосу. Медь — металл красного цвета, имеет металлический блеск, хорошо проводит электрический ток, поэтому медь применяют при изготовлении проводов.
Такие жидкости, как уксусная кислота и этиловый спирт, также легко различить. Уксусная кислота очень хорошо растворима в воде. Этиловый спирт имеет характерный запах и хорошо смешивается с водой.
Кристаллы медного купороса имеют синий цвет, легко растворяются в воде, образуя голубой раствор.
У всех в аптечке есть марганцовка, её также несложно распознать. Марганцовка представляет собой тёмно-фиолетовые кристаллы, которые хорошо растворяются в воде и образуют раствор ярко-розового цвета.
Однако многие вещества определить достаточно сложно. Как распознать кислород и углекислый газ, ведь эти газы бесцветны и не имеют запаха? Или как узнать, какое вещество находится в пробирке: раствор кислоты или соли? Какой газ находится в сосуде?
Для этого проводят химические реакции, в результате которых происходят изменения с веществами. Эти специфические признаки мы можем определить с помощью наших органов чувств: зрения, обоняния, слуха. Такие химические реакции называются качественными.

То есть качественные реакции — это химические превращения, сопровождающиеся характерными признаками, с помощью которых проводят распознавание веществ.
Основными признаками химических реакций являются: изменение окраски, выпадение осадка, выделение газа, появление запаха, выделение тепла и света.
Такие явления при проведении качественных реакций называются аналитическими сигналами.
Если опустить тлеющую лучинку в пробирку с кислородом и углекислым газом, то в одной пробирке лучинка гаснет, а в другой — ярко вспыхивает. Этот опыт позволяет определить, в какой пробирке кислород, а в какой — углекислый газ. В той пробирке, где лучинка гаснет, находится углекислый газ, так как углекислый газ не поддерживает горение. В той пробирке, где лучинка вспыхнула, находится кислород, потому что кислород поддерживает горение.

А как отличить, например, углекислый газ от азота, ведь азот, как и углекислый газ, не поддерживает горение? Для этого существует качественная реакция на углекислый газ.
Если в стакан с углекислым газом добавить небольшое количество известковой воды и встряхнуть жидкость в стакане, то жидкость мутнеет. Таким образом, с помощью известковой воды или раствора гашёной извести можно обнаружить углекислый газ.

Если в пробирку с прозрачной известковой водой опустить стеклянную трубку и продуть через неё выдыхаемый воздух, то раствор мутнеет. Значит, и в выдыхаемом воздухе есть углекислый газ.
То есть вещество, с помощью которого проводят качественную реакцию, называется реактивом на определяемое вещество.

В нашем случае известковая вода является реактивом на углекислый газ и углекислый газ является реактивом на известковую воду.
Чтобы реакцию можно было считать качественной, аналитический сигнал на определённый реактив должен появляться только при взаимодействии с одним или немногими веществами. В противном случае трудно будет сделать вывод о том, какое вещество мы обнаружили с помощью реактива.
Например, крахмал можно обнаружить с помощью раствора йода и наоборот. Если капнуть несколько капель йодной настойки на кусочек картофеля, то наблюдается появление сине-фиолетовой окраски. Данная реакция является качественной на крахмал и подтверждает наличие крахмала в картофеле.

Таким образом, с помощью качественных реакций проводят распознавание веществ. Качественная реакция сопровождается аналитическим сигналом. Кислород и углекислый газ можно распознать с помощью тлеющей лучинки. Реактивом на углекислый газ является известковая вода и наоборот. Реактивом на крахмал является раствор йода.
- Как распознавать газы
- Имеет ли углекислый газ запах
- Как распознать карбонаты
- Вариант 3. Получение, собирание и распознавание углекислого газа
- Опыт 1. Получение, собирание и распознавание водорода.
- Опыт 2. Получение, собирание и распознавание углекислого газа.
- Опыт 3. Изучение состава солей.
- Опыт 4. Распознавание соединений неметаллов.
- Практическая работа №6. Получение, собирание и распознавание газов
Как распознавать газы
Как известно, вещества могут находиться в различных агрегатных состояниях, таких как: твердое, жидкое и газообразное. Но если твердые и жидкие вещества могут иметь окраску, которая является основным признаком для визуального определения химических соединений, то газы в большинстве случаев окраской не обладают. Тогда напрашивается вопрос, как же распознавать газы? Оказывается, не все так сложно и с помощью нехитрых приемов,а также по некоторым свойствам, можно вполне определить газообразные вещества.
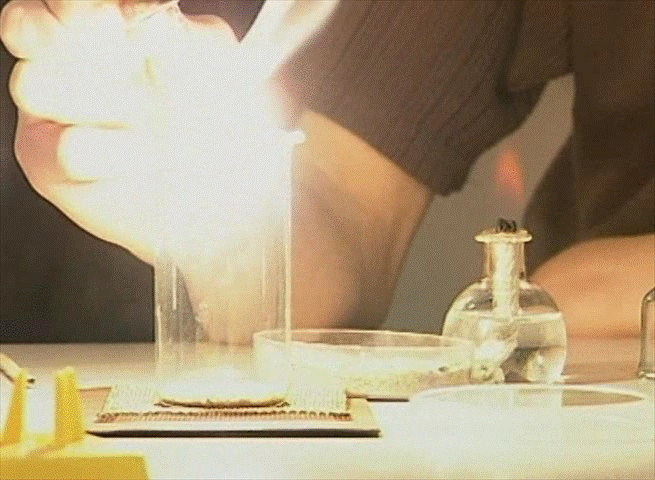
Кислород. Собирают его методом вытеснения воздуха или воды. Так как он тяжелее воздуха, то емкость можно не переворачивать, а просто в нее собирать газ. Чтобы определить, что получено именно это газообразное вещество, необходимо внести в сосуд с кислородом тлеющую лучинку, которая вспыхнет ярким пламенем. Так как газ поддерживает горение, следовательно, в данной емкости находится именно кислород.
Водород. Это газ без цвета и запаха, легче воздуха. Поэтому его собирают методом вытеснения воды или воздуха, но емкость при этом держат дном вверх. После собирания сосуд сразу закрывают. Для того, чтобы распознать вещество открывают емкость с водородом и сразу подносят к отверстию зажженную спичку. Слышен хлопок «пах». Именно этот хлопок свидетельствует о наличии водорода в сосуде.
Углекислый газ. Это вещество тяжелее воздуха, а потому его можно собирать прямо в стакан методом вытеснения воздуха. Для того чтобы определить, что собран углекислый газ, нужно внести в емкость с ним тлеющую лучину. То, что огонь сразу погаснет и является признаком наличия углекислого газа, так как он не поддерживает процесс горения.
Аммиак. Это газообразное вещество и его можно сразу определить по резкому удушливому запаху. Такой же «аромат» имеет нашатырный спирт, который используется при потере сознания.
Оксид азота (IV). Это газ, определяемый даже визуально, так как иное его название «лисий хвост», которое появилось из-за бурой окраски. Бурый газ очень ядовит и категорически противопоказан в незащищенной ситуации (только под тягой).
Метан. Сам по себе это газ без цвета и запаха, однако, в целях безопасности в него добавляют специальные «пахучие» вещества, которые помогают распознавать метан и предотвращать аварийные ситуации.
Озон. Это газообразное вещество, которое каждый чувствует после грозовых разрядов. Ощущение свежести после дождя с грозой дает именно озон. Таким образом, на вопрос: «Как распознавать газы» имеется один ответ – использовать простейшие навыки и приемы, полученные на уроках химии.
Обратите внимание на выполнение правил техники безопасности, так как водород с примесями взрывоопасен, а бурый газ нельзя получать без соблюдения мер предосторожности (тяги)
Забыли пароль? Еще не зарегистрированы?
Имеет ли углекислый газ запах
Углекислый газ на нашей планете является одной из главных составляющих окружающей среды. В больших количествах двуокись углерода содержится, к примеру, в воздухе и минеральных подземных водах. Без этого газа невозможен фотосинтез растений, а у живых организмов он является важнейшим компонентом обмена веществ.

В условиях атмосферного давления СО2 чаще всего находится именно в газообразном агрегатном состоянии. Однако при особых условиях, а в частности при пониженных температурах (от -78 °С), двуокись углерода способна превращаться в сухой лед.
Одной из особенностей углекислого газа является то, что весит он больше воздуха. Также СО2 очень хорошо растворяется в воде. Относится этот газ к типичным кислотным оксидам и взаимодействовать может со щелочами или водой.
Помимо всего прочего, СО2 не является горючим газом и даже не поддерживает горения. В отличие от своего ближайшего родственника угарного газа (СО), двуокись углерода не ядовита и не представляет собой слишком уж большой опасности для человека в плане отравлений.
Запаха углекислый газ, как и угарный, не имеет совершенно никакого. Причем касается это как газообразной его формы, так и твердой.
Обнаружить присутствие в помещении двуокись углерода человек, таким образом, не может. Единственное, в больших количествах СО2 иногда начинает раздражать слизистую носа.
Так коварно на организм человека, как угарный, углекислый газ не действует. Однако обращаться с ним нужно все же поосторожнее.
Поскольку весит СО2 больше воздуха, в помещении он всегда опускается вниз. И если его будет слишком много, он вытеснит от пола кислород, из-за чего у находящихся в комнате людей может начаться гипоксия или аноксемия.
Сила воздействия на организм человека углекислого газа невысока. Но при длительном его вдыхании у пострадавшего, помимо всего прочего, могут развиться и симптомы интоксикации. В данном случае все зависит от того, сколько двуокиси углерода попадет в организм.
С проблемой отравления СО2 зачастую сталкиваются, к примеру, аквалангисты или люди, плавающие под водой со слишком длинной трубкой для дыхания. В группу риска также попадают шахтеры, электросварщики, работники производств, специализирующихся на выпуске сахара, пива, сухого льда.
В избыточных количествах в организме человека углекислый газ начинает связывать гемоглобин. В результате у пострадавшего, как частный случай гипоксии, может развиться гиперкапния, сопровождающаяся такими симптомами, как тошнота, брадикардия или даже паралич дыхательной системы. Врачи в таких случаях обычно выписывают пострадавшим препарат «Ацизол», способный, помимо всего прочего, выгонять СО2 из организма.
- Симптомы отравления углекислым газом
- Вся правда об углекислом газе
Как распознать карбонаты
Что это за таинственные вещества, которые называются карбонатами? Как распознать карбонаты, например, во время практической работы, лабораторного опыта, в строительстве и даже на кухне? С этими веществами знаком буквально каждый, только далеко не все акцентируют на них свое внимание. А ведь они окружают нас повсюду – питьевая сода (гидрокарбонат натрия), обычный кусочек мела и мрамор (карбонат кальция), поташ (карбонат калия).

Реагентом на карбонаты являются ионы водорода, то есть достаточно провести реакцию с кислотой, которая наглядно продемонстрирует наличие карбонат-ионов. Для этого подойдет практически любая разбавленная кислота, например соляная.
Распознавание карбонатов в твердых веществах. Налейте в пробирку 5 мл соляной кислоты и опустите в нее несколько маленьких горошин мела (известняка). В другую пробирку с таким же количеством кислоты добавьте кусочки мрамора. В обеих пробирках произойдет моментальная химическая реакция, а именно, «вскипание», которое свидетельствует о наличие карбонат-ионов. Мгновенная реакция происходит вследствие образования угольной кислоты, которая сразу же разлагается на углекислый газ (оксид углерода IV) и воду. Именно выделяющийся углекислый газ и дает эффект «вскипания».
Распознавание карбонатов в растворе. Возьмите 2 мл раствора карбоната калия и прилейте к нему такое же количество разбавленной соляной кислоты. Также будет наблюдаться «вскипание» в виде выделения углекислого газа. Чтобы убедиться, что это действительно оксид углерода (IV), предварительно закройте пробирку пробкой с газоотводной трубкой, которую пропустите через известковую воду. Прозрачный раствор помутнеет за счет, вновь образовавшегося карбоната.
Распознавание карбонатов в кулинарии. Реакция, хорошо знакомая, если хотя бы раз приходилось наблюдать таинство выпекания пирогов с использованием соды. В рецепте написано «возьмите полчайной ложки соды и загасите ее лимонной или уксусной кислотой». Сода как раз представляет собой карбонат (или вернее гидрокарбонат) натрия, для гашения которой нужно взять раствор лимонной кислоты. Будет наблюдаться выделение «пузырьков» углекислого газа. Благодаря этому процессу тесто поднимается и становится пышным. Тот же процесс лежит в основе выпечки, если вместо кислоты использовать кисломолочный продукт, например, кефир и добавить в него питьевую соду. Таким образом, распознать карбонаты можно, имея даже «кулинарные» навыки.
Соблюдайте правила техники безопасности при работе с кислотами
Вариант 3. Получение, собирание и распознавание углекислого газа
Вариант 3. Получение, собирание и распознавание углекислого газа. При добавлении раствора уксусной кислоты к мрамору (мелу) наблюдается бурное выделение углекислого газа.

При внесении в пробирку горящей лучины лучина гаснет.
При пропускании углекислого газа через раствор известковой воды она мутнеет, а потом вновь становится прозрачной.
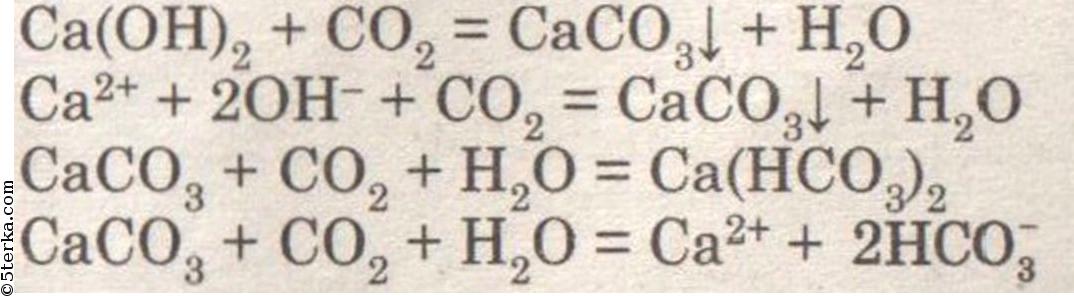

Решебник по химии за 11 класс (О.С. Габриелян, 2007 год), задача №3к главе «Практическая работа №1 Получение, собирание и распознавание газов».
Опыт 1. Получение, собирание и распознавание водорода.
Поместите в пробирку (рис. 113), закреплённую в штативе вертикально, 2 гранулы цинка и налейте 3 мл соляной кислоты. Закройте пробирку пробкой с вертикальной газоотводной трубкой. На трубку наденьте пробирку. Подождите 2-3 минуты, чтобы верхняя пробирка наполнилась водородом. Осторожно снимите пробирку с водородом и, не переворачивая её, а слегка наклонив, поднесите отверстием к пламени спиртовки. Каков характер получившегося хлопка? О чём это свидетельствует? Напишите уравнения протекающих реакций.
Опыт 2. Получение, собирание и распознавание углекислого газа.
Поместите в пробирку, закреплённую в штативе наклонно, кусочек мрамора. Налейте 2-3 мл соляной кислоты и закройте пробирку пробкой с газоотводной трубкой (рис. 114). Опустите свободный конец трубки в пробирку, содержащую известковую воду, так, чтобы пузырьки выделяющегося газа проходили через раствор. Что наблюдаете?
Напишите уравнения реакций в молекулярной и ионной формах.
Опыт 3. Изучение состава солей.
Докажите опытным путём, что в состав хлорида аммония входят катион аммония NH4 + и хлорид-анион Cl — .
Докажите опытным путём, что в состав сульфата аммония входят катион аммония NH4 + и сульфат-анион SO4 2-
Докажите опытным путём, что в состав гидрокарбоната аммония входят катион аммония NH4 + и гидрокарбонат-анион HCO3 — .
Опыт 4. Распознавание соединений неметаллов.
В четырёх пробирках под номерами без этикеток находятся кристаллические соли: сульфат калия, хлорид магния, карбонат натрия, силикат натрия. С помощью предложенных вам реактивов распознайте каждую соль, проведя качественные реакции на анионы. Напишите уравнения проведённых реакций в молекулярной и ионной формах.
При действии соляной кислоты на цинк наблюдается выделение газа:Zn + 2HCl ⟶ ZnCl2 + H2↑
При поджоге собранного газа раздаётся глухой хлопок, это свидетельствует о том, что водород не содержит примесей.2H2 + O2 ⟶ 2H2O
При действии соляной кислоты на известняк наблюдается выделение газа:CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑CaCO3 + 2H + + 2Cl — ⟶ Ca 2+ + 2Cl — + H2O + CO2↑CaCO3 + 2H + ⟶ Ca 2+ + H2O + CO2↑
При пропускании углекислого газа через известковую воду наблюдается помутнение раствора:Ca(OH)2 + CO2 ⟶ CaCO3↓ + H2OCa 2+ + 2OH — + CO2 ⟶ CaCO3↓ + H2OCa 2+ + 2OH — + CO2 ⟶ CaCO3↓ + H2O
При дальнейшем пропускании углекислого газа наблюдается растворение выпавшего карбоната кальция:CaCO3 + H2O + CO2 ⟶ Ca(HCO3)2CaCO3 + H2O + CO2 ⟶ Ca 2+ + 2HCO3 —
Доказательство того, что в состав входит катион аммония NH4 + :NH4Cl + NaOH ⟶ NH3↑ + H2O + NaClNH4 + + Cl — + Na + + OH — ⟶ NH3↑ + H2O + Na + + Cl — NH4 + + OH — ⟶ NH3↑ + H2O
Доказательство того, что в состав входит хлорид-анион Cl — :NH4Cl + AgNO3 ⟶ NH4NO3 + AgCl↓NH4 + + Cl — + Ag + + NO3 — ⟶ NH4 + + NO3 — + AgCl↓Ag + + Cl — ⟶ AgCl↓
1) Во все пробирки добавить воды.
2) Добавить щелочь. В пробирке с хлоридом магния выпадет белый осадок:MgCl2 + 2NaOH ⟶ 2NaCl + Mg(OH)2↓Mg 2+ + 2Cl — + 2Na + + 2OH — ⟶ 2Na + + 2Cl — + Mg(OH)2↓Mg 2+ + 2OH — ⟶ Mg(OH)2↓
3) Добавить соляную кислоту.
В пробирке с карбонатом натрия выделится газ:Na2CO3 + 2HCl ⟶ 2NaCl + H2O + CO2↑2Na + + CO3 2- + 2H + + 2Cl — ⟶ 2Na + + 2Cl — + H2O + CO2↑2H + + CO3 2- ⟶ H2O + CO2↑
В пробирке с силикатом натрия выпадет белый осадок:Na2SiO3 + 2HCl ⟶ 2NaCl + H2O + SiO2↓2Na + + SiO3 2- + 2H + + 2Cl — ⟶ 2Na + + 2Cl — + H2O + SiO2↓2H + + SiO3 2- ⟶ H2O + SiO2↓
4) В оставшуюся пробирку (с сульфатом калия) добавим хлорид бария, выпадет белый осадок:K2SO4 + BaCl2 ⟶ 2KCl + BaSO4↓2K + + SO4 2- + Ba 2+ + 2Cl — ⟶ 2K + + 2Cl — + BaSO4↓Ba 2+ + SO4 2- ⟶ BaSO4↓
Практическая работа №6. Получение, собирание и распознавание газов
Опыт 1. Получение, собирание и распознавание водорода
Соберите прибор для получения газов и проверьте его на герметичность. В пробирку положите 1—2 гранулы цинка и прилейте в нее 1—2 мл соляной кислоты. Закройте пробирку пробкой с газоотводной трубкой (см. рис. 43) и наденьте на кончик трубки еще одну пробирку. Подождите некоторое время, чтобы пробирка заполнилась выделяющимся газом.Снимите пробирку с водородом и, не переворачивая ее, поднесите к горящей спиртовке. Если водород взрывается с глухим хлопком, то он чистый, а если с «лающим» звуком, значит, водород собран в смеси с воздухом («гремучий газ»).
Вопросы и задания
1. Что происходит при взаимодействии цинка с соляной кислотой? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.3. Опишите физические свойства водорода, непосредственно наблюдаемые при проведении опыта.4. Опишите, как можно распознать водород.
Собрали прибор для получения газов и проверили его на герметичность. В пробирку положили 1-2 гранулы цинка и прилили в нее 1-2 мл соляной кислоты. Закрыли пробирку пробкой с газоотводной трубкой и надели на кончик трубки еще одну пробирку, подождали некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Сняли пробирку с водородом и не переворачивая ее поднесли к горящей спиртовке. Чистый водород взрывается с глухим хлопком.

Опыт 2. Получение, собирание и распознавание аммиака

Соберите прибор, как показано на рисунке 113, и проверьте его на герметичность.
В фарфоровую чашку насыпьте хлорид аммония и гидроксид кальция объемом по одной ложечке для сжигания веществ. Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте ее пробкой и укрепите в лапке штатива (обратите внимание на наклон пробирки относительно отверстия!). На газоотводную трубку наденьте сухую пробирку для собирания аммиака.
Пробирку со смесью хлорида аммония и гидроксида кальция прогрейте сначала всю (2—3 движения пламени), а затем в том месте, где находится смесь.
Для обнаружения аммиака поднесите к отверстию перевернутой вверх дном пробирки влажную фенолфталеиновую бумажку.
Прекратите нагревание смеси. Пробирку, в которой собран аммиак, снимите с газоотводной трубки. Конец газоотводной трубки сразу же закройте кусочком мокрой ваты.
Немедленно закройте отверстие снятой пробирки большим пальцем и опустите в сосуд с водой. Палец отнимите только под водой. Что вы наблюдаете? Почему вода поднялась в пробирке? Закройте пальцем отверстие пробирки под водой и выньте ее из сосуда. Добавьте в пробирку 2—3 капли раствора фенолфталеина. Что наблюдаете?
Проведите аналогичную реакцию между растворами щелочи и соли аммония при нагревании. Поднесите к отверстию пробирки влажную индикаторную бумажку. Что наблюдаете?
1. Что происходит при взаимодействии хлорида аммония и гидроксида кальция? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.2. Опишите физические свойства аммиака, непосредственно наблюдаемые в опыте.3. Опишите не менее двух способов распознавания аммиака.
Собрали прибор для получения аммиака и проверили его на герметичность. В фарфоровую чашку насыпали хлорид аммония и гидроксид кальция объемом по 1 ложечке для окисления веществ. Смесь перемешали стеклянной палочкой и высыпали в сухую пробирку. Закрыли ее пробкой и укрепили на лапке штатива. На газоотводную трубку надели сухую пробирку для собирания аммиака. Пробирку со смесью хлорида аммония и гидроксида кальция нагрели.

Опыт 1. Получение, собирание и распознавание кислорода

Соберите прибор, как показано на рисунке 114, и проверьте его на герметичность. В пробирку насыпьте примерно на ¼ ее объема перманганата калия KMnO4 и у отверстия пробирки положите рыхлый комочек ваты. Закройте пробирку пробкой с газоотводной трубкой. Укрепите пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород. Наличие кислорода в сосуде проверьте тлеющей лучинкой.
1. Что происходит при нагревании перманганата калия? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.3. Опишите физические свойства кислорода, непосредственно наблюдаемые в опыте.4. Опишите, как вы распознавали кислород.
Собрали прибор для получения кислорода и проверили его на герметичность. В пробирку насыпали примерно на 1/4 ее объема перманганата калия у отверстия пробирки положили рыхлый комочек ваты.
Закрыли пробирку пробкой с газоотводной трубкой. Укрепили пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород.

Опыт 2. Получение, собирание и распознавание оксида углерода (IV)
В пробирку поместите несколько кусочков мела или мрамора и прилейте 1—2 мл разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку, в которой находится 2—3 мл известковой воды.Несколько минут наблюдайте, как через известковую воду проходят пузырьки газа.
1. Что происходит при взаимодействии мела или мрамора с соляной кислотой? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.2. Рассмотрите проведенную реакцию в свете теории электролитической диссоциации.3. Опишите физические свойства оксида углерода (IV), непосредственно наблюдаемые в опыте.4. Опишите, как вы распознавали оксид углерода (IV).
В пробирку поместили несколько кусочков мела и прилили 1 мл разбавленной соляной кислоты. Закрыли пробирку пробкой с газоотводной трубкой. Конец трубки опустили в другую пробирку, в которой находится 2-3 мл известковой воды. Наблюдаем как через известковую воду проходят пузырьки газа.

Эта реакция является качественной на углекислый газ.
Проверяем с прибором как дышится на улице, в общественном транспорте, офисе, однушке, включая кухню, и в салоне автомобиля с закрытой заслонкой. В последнем случае шанс умереть отнюдь не призрачный, а вполне реальный, и его можно легко вычислить.

В чем проблема
Вдыхаем кислород, выдыхаем углекислый газ. В выдохе его примерно 4,5%, в то время как в окружающем пространстве должно быть около 0,04%. Исследованиями доказано, что даже при достаточном количестве кислорода увеличение доли углекислого газа приводит к появлению головной боли, сонливости, сложности с концентрацией внимания, а при высоком содержании (0,5% и выше) к потере сознания.
В чем измеряется и сколько должно быть
Из-за малых величин концентрацию CO2 обычно выражают в количестве частей на миллион (ppm), что эквивалентно десятитысячным долям процента.
Ниже наименее пугающая картинка из интернета, которая расскажет как повышенная концентрация углекислого газа сказывается на самочувствии. Цифры на шкале — те самые ppm.
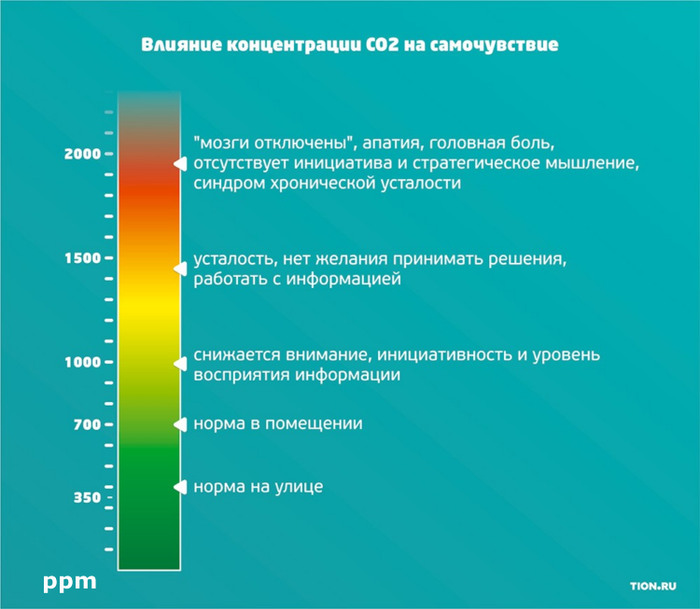
Важный вопрос – сколько может “надышать” человек? В интернете мне удалось найти такую цифру: за один час в закрытом помещении 20 м2 один человек поднимет уровень СО2 на 50 ppm. По моим собственным наблюдениям это вполне похоже не правду.
Ну а теперь к методике и замерам.
Все измерения проводились недорогим комнатным прибором HT-501, обзор которого я постил вот тут.
В нем установлен датчик CO2 шведской компании SenseAir. Приборчик может сохранять статистику с заданным интервалом и потом выгружать ее в специальную прогу на ПК. Делая замеры я просто носил прибор в руке или открытой сумке и потом изучал полученные данные.
Сами замеры производились в феврале.
Замеры на улице
В мегаполисе (Москве), если не подходить к дорогам с интенсивным движением, прибор показывает значения в пределах 400-450 ppm. В центре города на тротуарах оживленных улиц показатели могут подняться до 620 ppm.
Замеры в офисе
В нашем просторном опенспейсе с хорошей вентиляцией воздух был примерно как на улице — 450-500 ppm. Но в какой-то из дней вентиляция дала сбой, и типичным значением CO2 стало 950 ppm. Причем к вечеру оно поднималось до 1200 ppm.
Из личных ощущений: как только показатели уходили за 1100 ppm, у окружающих возникало коллективное желание проветрить. После короткого проветривания показатели опускались до 850 ppm.
Замеры в однушке
Если регулярно не проветривать, типичный уровень углекислого газа в квартире 28 м2 и потолками 2,5 м при нахождении в ней двух взрослых колеблется от 800 до 1300 ppm в зависимости от забортной температуры. И чем холоднее на улице, тем лучше начинает работать вентиляция (это в моем доме так, в других может быть по-другому).
Кухня 5,5 м2 с газовой плитой
Кухня — самое интересное место в плане замеров. При закрытой двери одна включенная в полсилы конфорка (на фото ниже) за 15 минут нагоняет более 2300 ppm (вентиляция при этом тянет исправно).

Тот же самый эксперимент, но с открытой дверью и выставленным на зимнее проветривание окном, дает за этот же промежуток времени цифру в 1600 ppm. Ну а если с закрытой дверью и две конфорки — через 15 минут будет 2700 ppm на столе и 3300 ppm на уровне головы в центре помещения.

Комната 15 м2
С закрытой дверью и закрытыми пластиковыми окнами двое взрослых и один ребенок за восемь часов сна поднимают уровень CO2 с 1000 до 2100 ppm. Если оставить окно на зимнее проветривание (щель), то уровень будет стабилизироваться примерно на 1350 ppm. Все то же, но с открытой дверью — 900-1200 ppm.
Почему открытие на зимнее проветривание дает такой заметный эффект? Просто воздух начинает протягиваться из щели окна через комнату и в вентиляцию. Если закрыть щель, комната становится полностью изолированным помещением.
Просто для справки: как себя чувствуешь, когда проснулся, а на датчике 2800 ppm? Духота, жара, тяжелая голова как с похмелья, хочется поскорее выйти на улицу или постоять, подышать у открытого окна.
Замеры в московском метро
Вообще в метро душновато. На станциях и переходах показатели колебались в пределах 750-1250 ppm. Причем день ото дня показатели менялись. В полупустом вагоне “Оки” (все сидячие заняты и немного стоячих) датчик фиксировал примерно 1300 ppm. А в час пик там начинался ад.
Когда люди набивались как селедка в бочку, датчик на уровне пояса стабильно фиксировал 1850 ppm. Поднять его на уровень головы и сделать замеры было уже невозможно. Думаю, он бы зашкаливал, поскольку все вокруг выдыхают именно в верхнее пространство.
Ощущение от нахождения в таких условиях: легкое головокружение, учащенное дыхание и огромное желание выйти и подышать немного. Как люди так катаются каждый день — не представляю.
В подмосковной электричке
В забитом тамбуре гуляют сквозняки, однако уровень CO2 находится примерно на отметке 1400 ppm. В самом вагоне ситуация хуже. При полностью занятых сидячих местах, но в отсутствии стоячих пассажиров, уровень углекислоты составил 2200 ppm.
Выводы: кто виноват и что делать
Эта часть специально для тех, кто начал читать отсюда.
Начнем с общественного транспорта. В нем практически везде душновато, за исключением, пожалуй, маршруток с высокими потолками, где еще можно увидеть приемлемый уровень в 700 ppm.
Очень туго в метро в час пик и ничуть не лучше в электричках. Там зашкаливает даже когда есть сидячие места.
В офисах раз на раз не приходится. И примерно у половины населения опенспейсов возникает желание проветрить, когда уровень начинает превышать 1100 ppm.
В квартире этот уровень воспринимается по-другому, и проветрить хочется когда на датчике более 1300-1400 ppm. И главный совет всем владельцам пластиковых окон — проветривайте почаще, а лучше всегда оставляйте открытой щель зимнего проветривания (это когда ручка повернута градусов на 20 от вертикали).

Это зимой. А летом окна лучше держать открытыми.
Из прочего, самый ад — на кухне с газовыми плитами. Если включена вполсилы пара конфорок и закрыты окна и двери, то через 15 минут на уровне головы будет 3500 ppm. И это при хорошо работающей вентиляции.
Отдельный привет любителям поспать в машине с закрытыми окнами. Очень велик шанс не проснуться. То же можно сказать и про ситуацию, когда вы забыли открыть заслонку забортного воздуха после обгона чадящего грузовика. Показатели в салоне начинают шкалить очень быстро.








