Вода – источник жизни на нашей голубой планете. Она есть в клетках всех живых организмов. Это самое распространённое в мире вещество. Вода – один из важнейших факторов, определяющих природные условия на Земле, и влияет на формирование климата и рельефа территории.
Слово “вода” происходит от древнегерманского “текучий, мокрый”.
Природная вода загрязнена большим количеством разнообразных химических элементов, но не все из них полезны для организма. К веществам, присутствие которых нежелательно, относятся сульфаты – растворенные соли серной кислоты в виде анионов. В земной биосфере образуется более 150 различных минералов серы. В основном, среди них преобладают сульфатные соединения. Вода с сульфатами, концентрация которых намного превышает допустимую стандартами норму, не должна употребляться для питья и приготовления пищи. Её нежелательно применять для полива сельхозугодий, поения скота, технических нужд.

Автоматические анализаторы воды, стоков и канализации
- Внесены в гос.реестр средств измерений РФ
- Автоматическая передача данных по GSM
Вода, текущая из крана в квартире, и вода из природных водоемов содержит растворенные соли. Минералы обнаруживаются в капле дождя и в скважинах, в сточных заводских водах и в ливневой канализации. Состав минеральных солей в природной воде, а также их количество зависит от геологических особенностей региона, но чаще всего в воде обнаруживаются неорганические соли – хлориды и сульфаты кальция, магния, калия и натрия, бикарбонаты.
Природные воды находятся в постоянном контакте с атмосферой, почвой и недрами земли и представляют собой различающиеся по составу растворы минеральных веществ, газов и органических соединений. На физико-химический баланс водных растворов влияют обитатели растительного и животного происхождения и продукты их жизнедеятельности. Все виды источников содержат растворенные соли, общее содержание которых составляет минерализацию воды. Также его могут называть солесодержанием воды. Меньше растворенных соединений содержат талая и дождевая вода, больше – воды морей и соленых озер. Высокая концентрация ионов солей и органических продуктов в воде изменяет ее вкус на неприятный горький или соленый, влияет на осмотическое давление и водный баланс, что в свою очередь приводит к нарушениям в функционировании важных систем жизнедеятельности организма человека.
Солесодержание воды – это суммарное содержание в водном растворе минеральных неорганических солей, которое характеризует степень минерализации воды:
- пресные – менее 1 г/л;
- солоноватые – 1 – 10 г/л;
- соленые – 10 – 50 г/л;
- рассолы – более 50 г/л.
В природных источниках превалируют катионы и анионы Mg2+, Na+, K+, Ca2+, HCO3-, SO42-, Cl-. По соотношению концентраций анионов в воде определяют ее гидрокарбонатную, сульфатную или хлоридную природу, а по преобладающему катиону различают магниевую, натриевую и кальциевую воду. Все ионы даже в незначительных концентрациях оказывают влияние на потребительские качества водного раствора. По этим критериям выделяют четыре типа вод:
- тип: HCO3- ˃ Ca2+ + Mg2+ (щелочные, мягкие воды; солевой состав представлен соединениями Ca(HCO3)2, Mg(HCO3)2, NaHCO3, Na2SO4, NaCl);
- II тип: HCO3- ˂ Ca2+ + Mg2+ ˂ HCO3- + SO42- (воды большинства рек и озер малой и умеренной минерализованности, содержащие Ca(HCO3)2, Mg(HCO3)2, CaSO4, MgSO4, MgCl2, NaCl);
- III тип: HCO3- + SO42- ˂ Ca2+ + Mg2+, Cl- ˃ Na (воды морей, океанов, соленых озер, содержащие Ca(HCO3)2, Mg(HCO3)2, CaSO4, MgSO4, MgCl2, NaCl);
- IV тип: кислые с полным отсутствием бикарбонат-ионов (болотные, вулканические, кислые сточные воды).

Пресная вода — вода, содержащая относительно небольшое количество соли. Это может быть определено различными способами. В классификации вод, благодаря содержанию минеральных соединений, пресной водой является вода, содержащая от 100 до 500 мг / л минеральных соединений. Согласно одной из классификаций подземных вод, воды с содержанием минералов ниже 1 г / л считаются пресными (слабоминерализованными, нормальными) водами. Другие системы могут иметь соленость ниже 0,5 ‰. Вся пресная вода на земном шаре поступает в результате процессов испарения и конденсации (возможно, повторной сублимации ).
Доступ к пресной воде является фактором, определяющим жизнь и выживание многих видов растений и животных (включая человека). Человек может пить только пресную воду (как морская вода, так и брахическая вода не может потребляться в прямой форме), получая ее из поверхностных или подземных вод .
Подземную пресную воду можно разделить на ультрапресную М <0,01 г / дм, свежую 0,01M <0,5 г / дм и акратопеги 0,5M <1,0 г / дм.
Сравнение с морской водой
Помимо количества растворенных солей, пресные воды отличаются от морской воды и по своему химическому составу . В морской воде преобладают хлориды , которые в пресной воде встречаются в незначительных количествах, но преобладают карбонаты . Наиболее важным из них, на долю которого приходится около 60% всех растворенных твердых веществ, является карбонат кальция
- Что такое сульфаты в питьевой воде
- Методы определения солесодержания воды
- Определение солесодержания воды гравиметрическим методом
- Влияние минеральной воды на человека
- Классификация воды в бальнеологии
- Низкий уровень минерализации
- Средний и высокий уровни
- Купание в высокоминерализованных источниках
- Нормы солесодержания в водах разного назначения
- Природные и сточные воды
- Что мы узнали?
- Расчет сухого остатка
- Нормы по СанПиН
- Норма сульфатов в воде
- Виды воды
- Таблица 1. Классификация воды по содержанию солей
- Влияние на антропную среду
- Ливневые коммуникации и водопроводы
- Физические свойства
- Чем полезны сульфаты в питьевой воде
- Минеральная водоподготовка
- Очистка
- Дистилляция
- Электродиализ
- Обратный осмос
- Обогащение
- Удаление сульфатов из питьевой воды
- Как определить сульфаты в воде
- Интересные факты
- Охрана воды
- Запасы пресной воды на Земле
- Откуда берутся растворенные в воде сульфаты
- Состав воды
- Какой воды на земле больше
- Гидросфера
- Сульфаты в воде – вред и польза
- Подведение итогов
Что такое сульфаты в питьевой воде
Сульфаты в воде – это анионы (заряженные отрицательно ионы SO42-) солей серной кислоты H2SO4. Это минералы, практически повсеместно присутствующие в питьевой воде из-за способности растворяться и вступать во взаимосвязи с её молекулами. Это бесцветные кристаллические вещества, которые всегда есть в слабоминерализованных водах. При соединении сульфатных солей с иными веществами водный раствор может менять окраску.
Какие сульфаты в воде присутствуют чаще всего – наиболее активны двухвалентные основания бария Ba2+, кальция Ca2+, стронция Sr2+. Часто встречаются соединения магния MgSO4, калия K2SO4, натрия Na2SO4. Они образуются вблизи земной поверхности при повышенной концентрации кислорода, поэтому всегда присутствуют в поверхностных водах, проникают глубоко в грунт, испаряются и накапливаются во всех видах атмосферных осадков. Достаточно часто в воде одновременно присутствуют и хлориды, и сульфаты.
Сульфатные ионы неустойчивы – в природной среде сера постоянно совершает сложный круговорот, в который включены средние (M2SO4) и кислые (MHSO4) сульфаты, содержащиеся в природных водах. При увеличении степени минерализации ионы образуют устойчивые соединения: BaSO4, CaSO4. При недостатке кислорода сульфатные соли под действием бактерий превращаются в сульфиды. При появлении кислорода вновь окисляются и переходят в сульфаты. Это процесс можно наблюдать в редко используемых водопроводных сетях, где застаивается и заиливается вода.
Методы определения солесодержания воды
Солесодержание водного раствора определяют методом кондуктометрии или гравиметрии.
Кондуктометрия позволяет определить солесодержание в воде по электропроводности- цифровом выражении способности воды проводить электрический ток. Электрическая проводимость воды зависит от концентрации растворенных солей и температуры. Больше всего на этот показатель влияют K+, Ca2+, Mg2+, Na+, SO42-, Cl-, HCO3-. По значениям электропроводимости можно приближенно судить об общем солесодержании в воде.
Определение солесодержания воды гравиметрическим методом
Гравиметрический метод точнее показывает общее содержание минеральных веществ в воде. Методики и порядок проведения химического анализа устанавливает ГОСТ 18164-72. Пробу воды подвергают испарению на водяной бане. После удаления видимой воды фарфоровую посуду с сухим составляющим сушат в термостате при 108 – 111°С до постоянной массы.
Солесодержание воды высчитывают по отношению разности массы чашки с оставшимся после прокаливания содержимым и массы пустой посуды к объему пробы воды, взятой для анализа. MgCl2, CaCl2 гигроскопичны и подвергаются гидролизу во время нагревания, кристаллогидраты CaSO4, MgSO4 трудно отдают воду, что меняет результаты исследования в сторону завышенных показателей.
Для уменьшения влияния этих эффектов на конечный результат к пробе во время выпаривания добавляют химически чистый Na2CO3. В результате CaSO4, MgSO4 переходят в безводные CaCO3, MgCO3. Воду из кристаллогидратов Na2SO4 удаляют сушкой при 140 – 190°С.
Влияние минеральной воды на человека
Воды минеральные с содержанием солей до 1 г/дм3 включительно относятся по ГОСТ Р 54316-2011 к столовым водам. В минеральной столовой воде из природных источников мало растворённых веществ, поэтому их воздействие на человеческий организм небольшое. Столовые воды не имеют ярко выраженного привкуса, лишены запаха. Воду с низкой минерализацией не возбраняется использовать для приготовления блюд и ежедневного питья.
Широко известны потребителю столовые минеральные воды «Ессентуки», Evian, «Боржоми», BonAqua, «Нарзан», «Святой источник», Aqua Minerale, «Архыз».
Минеральные столовые воды систематизируются по различным показателям.
По газовому наполнению выделяют минеральные столовые воды:
- сульфидные (сероводородные) – содержат свыше 10 мг/дм3 общего сероводорода;
- азотные – концентрация двухвалентного азота (N₂) до 20–25 мг/дм3;
- углекислые – содержат не менее 0,5 г/дм3 диоксида углерода (CO₂).
Классификация воды в бальнеологии
Минеральные воды подразделяются на шесть бальнеологических групп. Эту классификацию минеральных вод, используемую и в настоящее время, составили
В. В. Иванов и Г. А. Невраев в 1964 году.
Низкий уровень минерализации
К слабоминерализованной воде относят воду, содержащую до 50-100 мг/дм3 солей. В такой воде практически нет минералов, и на вкус она неприятна. При длительном употреблении воды с низким уровнем минерализации в организме сбивается обмен веществ, к примеру, в тканях уменьшается содержание хлоридов. Но в тоже время воды с невысокой минерализацией способствуют выведению из почек и мочевого пузыря слизи, песка и даже мелких камней.
Средний и высокий уровни
Большинство питьевых минеральных вод среднеминерализованы, в том числе и ценные углекислые воды.
Воды средней минерализации интенсивно воздействуют на ткани и органы человека, в том числе влияют на работу желчного пузыря и кислотообразование в желудке, на перистальтику кишечника.
Избыток солей в питьевой воде, когда их концентрация превышает 1000 мг/дм3, делает вкус питья неприятным. Высокий уровень минерализации часто обусловлен содержанием калия, солей соляной кислоты и натрия.
Питье такой воды приводит к неблагоприятным отклонениям в здоровье:
- усиливается жажда;
- нарастает отечность тканей;
- возрастает риск перегрева;
- нарушается работа кишечника (усиливается перистальтика).
Высокоминерализованные воды хороши для приготовления для ванн. Лечебные ванны из рассолов с минерализацией не более 150 г/дм3 допускается использовать, не разбавляя пресной водой. Воды высокой минерализации находят лишь ограниченное питьевое применение – преимущественно для получения послабляющего эффекта.
Купание в высокоминерализованных источниках
Воды с высоким содержанием солей во время купания или принятия лечебных ванн химически воздействуют на организм, раздражая экстерорецепторы кожи. Внутрь организма также проникают некоторые ионы и микроэлементы, стимулируя интерорецепторы сосудов и внутренних органов. Действие продолжается и после прекращения контакта с высокоминерализованной водой, так как соль остается на коже в виде тончайшего слоя.
Сероводородная вода сочинского курорта «Мацеста» – пример ценного высокоминерализованного лечебного ресурса. Ванны с «огненной водой» Мацесты вызывают покраснение кожи. Кровеносные сосуды расширяются, в организме происходят гемодинамические сдвиги. Улучшение кровотока восстанавливает и нормализует структуру тканей органов и их систем, повышает их функциональную активность.
Другой известный источник высокоминерализованных вод находится на Ближнем Востоке. Воды Мертвого моря, бессточного соленого озера, отличаются самой высокой степенью солености в мире – от 300 до 350‰. Богатая «химия» воды представлена двумя десятками минералов и солей, среди которых хлорид калия, кальция, магния, натрия, бромиды. Обычная морская вода содержит 77% NaCl, но в Мертвом море концентрация хлористого натрия не превышает 25-30%, зато содержание солей магния (хлорида и бромида) достигает 50%. Магний и бром успокаивают расшатанную нервную систему, повышают стрессоустойчивость. Присутствие в лечебной ванне, созданной природой, солей калия и кальция нормализует кровяное давление.
Купание в высокоминерализованной воде при соблюдении рекомендаций врача приносит только пользу и омолаживает организм.
Нормы солесодержания в водах разного назначения
Нормативно установлены разные ПДК минеральных солей для водных растворов в зависимости от целей использования.
- Дистиллированная вода согласно ГОСТ 6709-72 не должна иметь солесодержание более 5 мг/л.
- ПДК минеральных веществ в воде для питьевых целей не может превышать 1000 мг/л, что соответствует пресной воде. Электропроводимость такой воды – 2500 мкСм/см при 20°С. Верхний предел в 1500 мг/л допустим в отдельных случаях для частной ситуации с учетом санитарной обстановки в определенном населенном пункте.
- В соответствии с нормами ГОСТ Р 54316-2011 степень солесодержания в минеральных природных питьевых водах может находиться в пределах от 1000 до 1500 мг/л.
Оценку пригодности водных источников для питьевого водоснабжения проводят в соответствии с правилами, установленными в ГОСТ Р 51232-98, СанПиН 2.1.5.980-00, СанПиН 2.1.4.1074-01. Вода должна быть безопасной, с безвредным биохимическим составом и обладать допустимыми органолептическими параметрами. Для ежедневного питья рекомендовано использовать воду с общим солесодержанием 0,2 – 1 г/л.
Допустимое солесодержание питательной воды современных паровых котлов устанавливает ГОСТ 20995-75. В установках барабанного типа допустимое максимальное солесодержание котловой воды должно быть таким, при котором котел продуцирует требуемое количества пара. При этом допустимое солесодержание химически обработанной воды, являющейся частью питательной воды (остальная часть – турбинный и производственный конденсаты), зависит от доли такой воды в общем растворе.
На электростанциях теплофикационного типа, вырабатывающих кроме электрической, тепловую энергию, потери пара и конденсата могут достигать существенных величин. По этой причине добавляемая в питательную воду химически обработанная вода должна быть с низким солесодержанием.
Еще более чувствительны к солесодержанию питательной воды барабанные котлы сверхвысокого давления, когда пар приобретает значительную способность к растворению различных солей. Становится необходимым сводить к минимуму содержание ионов в котловой воде. В этом случае применяют глубокое обессоливание добавляемой в питательную воду химически обработанной воды.
Для прямоточных котлов солесодержание котловой воды должно быть минимальным, равноценным высококачественному дистилляту, поскольку практически большая часть солей попадает в пар, идущий на турбину.
Возникает также необходимость глубокого обессоливания турбинного конденсата в случаях неудовлетворительной плотности конденсаторов турбин на электростанциях высокого и сверхвысокого давления.
Природные и сточные воды
Минеральное наполнение природных вод очень разное. Есть пресные воды с минерализацией менее 1 г/дм3 и рассолы с концентрацией солей более 50 г/дм3.
Атмосферные осадки слабоминерализованны, общая минерализация дождя и снега колеблется в пределах от 10 до 30 мг/дм3. Зимой солей в осадках больше, чем в летние месяцы. Снежинка благодаря своей структуре способна захватить из воздуха большее количество примесей. В тундре и над тайгой осадки чище, так как атмосфера не загрязнена, а над пыльными пустынями и степями минерализация осадков резко возрастает. На побережьях дождь содержит больше хлоридов, чем в глубине континента, где преобладают сульфаты в виде диоксида серы.
В природных водах превалируют катионы Mg2+, Na+, K+, Ca2+ и анионы HCO3-, SO42-, Cl—. По главному аниону воды подразделяют на три класса – гидрокарбонатный, хлоридный, сульфатный.
По преобладающему катиону определяется группа вод:
- магниевая;
- натриевая;
- кальциевая.
Природные воды различного происхождения обычно имеют различный солевой состав и относятся соответственно к разным классам и группам.
Свой негативный вклад в изменение минерализации природных вод вносят промышленные сточные воды, а также городские «ливневки». Резко возрастает приток солей в реки ранней весной, когда тает снег, смешанный с противогололедным реагентом. В стоках с улиц городов показатель минерализации колеблется от 400 до 800 мг/дм3.
Общая минерализация многих производственных сточных вод достигает 1000-3000 мг/дм3. Высокоминерализованные сточные воды промышленных производств (ВМСВ) признаются экологами одним из самых распространенных и опасных загрязняющих факторов. В производственных стоках ТЭЦ, горнодобывающей промышленности, гальванических производств присутствуют высокие концентрации солей натрия, магния и кальция. Для очистки заводских сточных вод, насыщенных солями в самых причудливых сочетаниях, рационально использовать комплексную технологию глубокого обессоливания на базе двухступенчатого обратного осмоса.
Пресной водой утоляют жажду, а также поливают растения. В целом человеку пресная вода нужна значительно больше, чем соленая, но ее очень мало. Количество пресной воды на Земле меньше количества соленой примерно в 30 раз.

Самый большой источник пресной воды – это ледники, на них приходится 90% пресной воды мира. Но используются ледники мало, ведь они находятся вдалеке от мест проживания людей.
Главный для человека источник пресной воды – это реки и озера. Хотя существуют соленые озера, всё же основная их часть заполнена именно пресной водой.

Реки – это источник не только воды, но и энергии. На ней можно построить гидроэлектростанцию. Течение воды вращает турбину этой станции, в результате этого и вырабатывается электричество.
В случае, когда воды рек и озер не хватает, используют подземные источники воды. Ещё один источник пресной воды – это дожди. С неба всегда падает чистая вода, которая как раз и наполняет реки и озера. Есть специальные устройства, которые помогают собирать дождевую воду.
Что мы узнали?
Вот краткий список основных сведений о воде, ее составе и свойствах:
- Молекула воды состоит из 2-х атомов водорода и 1 атома кислорода
- Лед легче воды
- Вода – единственное на планете вещество, способное пребывать в трех агрегатных состояниях: газообразном, твердом, жидком
- В воде всегда присутствуют примеси
- Количество морской воды на планете гораздо больше, чем пресной
- Вода регулирует температуру планеты

Спрашивай! Не стесняйся!
Не все нашли? Используйте поиск по сайту
Расчет сухого остатка
Величина сухого остатка выражается в мг/дм3. Показатель минерализации рассчитывается по формулам, приведенным в таблице ниже.
Нормы по СанПиН
Для питьевой воды, поступающей потребителю из системы централизованного водоснабжения, величина сухого остатка в новых СанПиН 2.1.3684-21, вступивших в силу с 1 марта 2021 года, осталась на прежнем уровне – 1000 мг/дм3. Показатель сухого остатка в колодцах и скважинах, снабжающих население питьевой водой, не должен превышать 1500 мг/дм3.
Норма сульфатов в воде
В природной воде концентрация солей изменяется в больших пределах:
- В мягких дождевых водах – 1-50 мг/дм3.
- В поверхностных водоемах – 150-300 мг/дм3.
- В открытых водоемах состав воды особенно резко подвержен сезонным колебаниям. В разное время года он может значительно различаться.
Допустимое количество сульфатов в воде должно находиться в пределах 100-150 мг/литр и не должно превышать 500 мг/л. Для жидкостей хозяйственно-технического значения допустимый предел тоже составляет 500 мг/дм3. Требования ЕС намного жестче: ПДК не выше 250 мг/дм3.
При нормировании параметров руководствуются ГОСТ на определение сульфатов в воде. Показатели определяют раздельно для каждого элемента: для сульфата магния – 400-600 мг/л, для солей кальция – 350-800 мг/дм3.
Виды воды

Вся вода делится на категории:
- Солёная (моря, океаны)
- Пресная (реки, озера, ледники, подземные воды)
- Дождевая
- Минеральная
- Вода, обработанная человеком (водопроводная, канализационная, дистиллированная, искусственная)
На планете примерно 96,5 % воды приходится на долю морской воды. Пресной – намного меньше. Её доля – около 2,5 %, причём большая часть – в ледниках и грунтовых водах. Менее 0,3 % от всей пресной воды содержится в реках, озёрах и атмосфере, а в живых организмах – всего 0,003 %.
У природных вод есть важный признак – прозрачность. От этого зависит, как глубоко смогут проникнуть солнечные лучи в толщу воды. Цветность определяется количеством растворенных органических соединений, которые окрашивают воду при прохождении её через торфяные и гумусные слои почвы.
Природная солёная вода содержит большое количество разных примесей минеральных и органических соединений. Количество этих веществ оказывает влияние на плотность воды. Самые плотные в природе это морская и минеральная воды. Самой плотной считается вода Мёртвого моря. По степени солёности вода делится на несколько категорий:
Таблица 1. Классификация воды по содержанию солей
В пресной воде тоже есть соли. В основном это кальций и магний. Для такой воды есть характеристика жёсткости. Чем больше содержание примесей, тем более жёсткой называют воду.
Чистой воды в природе никогда не бывает. Вода хорошо растворяет в себе разные вещества – твердые, жидкие и газообразные. Даже дождевая вода пока падает на землю, захватывает из воздуха пыль и газы и растворяет их в себе.
Человек для своих нужд изменяет воду. В водопроводе течет пресная вода из рек и водохранилищ. Она проходит 5 стадий очистки, обеззараживается. В канализацию попадает вода загрязнённая примесями и частицами от человеческой жизнедеятельности. Прежде чем выпустить такую воду в окружающую среду, стоки очищают на специальных очистных сооружениях.
Дистиллированную воду используют в разных областях, чаще в научной и технической. Получают её, испаряя и затем осаждая пар на холодной поверхности. Примеси остаются в перегонном сосуде. Такая вода является наиболее чистой из всех возможных.
Пресная вода на планете распространена неравномерно. Есть области, где существует сильная её нехватка. Для решения проблемы в таких районах строят водоопреснительные станции. На этих станциях морскую воду выпаривают и получают дистиллированную воду, которая тоже непригодна для использования человеком. Её насыщают минеральными солями до показателей природной пресной воды.
Влияние на антропную среду
Высокая минерализация воды – настоящее бедствие для инженерных сооружений. Твердые грязно-белые частицы солей кальция и магния откладываются внутри труб, снижая скорость движения воды в коммуникациях. Накипь, нарастающая на нагревательных элементах бойлеров, снижает интенсивность теплообмена, способствует перегреву металлических поверхностей вплоть до поломки оборудования. Отложение солей на теплообменнике ведет к перерасходу топлива и потерям электроэнергии.
Ливневые коммуникации и водопроводы
Растворенные в воде соли кальция, магния, натрия и наличие углекислого газа, могут способствовать как образованию на трубах защитных пленок из нерастворимых карбонатов, тормозящих коррозию, так и появлению негомогенных пленок, ускоряющих разрушение водопровода. Сульфаты увеличивают электропроводность среды, активируя внутреннюю коррозию, а также косвенно способствую биологической коррозии. Хлориды встраиваются на место кислорода в защитную пленку и точечно воздействуют на металл. На металлических поверхностях коммуникаций образуются язвы, возникают течи.
Физические свойства

Вода – уникальное вещество на планете, способное быть в трех физических состояниях:
- Газообразное
- Жидкое
- Твердое
Если спросить человека, что такое вода, то самый популярный ответ будет: “Это жидкость” . Жидкое самое распространённое в природе состояние воды.
Изменение состояния воды возможно благодаря тому, что под действием температур меняется расстояние между молекулами. В твердой форме – молекулы наиболее близко расположены друг к другу. В жидкой – подальше. В газообразной – совсем далеко, что позволяет им отрываться. При температуре от 100°С и выше это пар. От 0°С до 100°С – это вода. А ниже 0°С – это лед.
Когда вода замерзает, ее молекулы выстраиваются в правильные шестигранные формы. Все кристаллы льда похожи друг на друга. Лед обладает уникальным свойством – он легче самой воды, из которой получен, и никогда не тонет в ней. Поэтому этому водоемы всегда замерзают сверху, что позволяет сохранить жизнь на дне.
В атмосфере всегда есть мельчайшие капельки воды. Но присутствие влаги мы замечаем только тогда, когда её количество увеличивается, формируя облака и туман.
Результаты химического анализа по определению общего солесодержания обуславливают выбор способа избавления водного раствора от минеральных ионов по степени извлечения: обессоливание либо опреснение. В первом варианте солесодержание снижают до показателей дистиллированной воды, во втором – до ПДК для питьевого водоснабжения.
Методики снижения солесодержания в воде разделяют на два типа:
- с изменением агрегатного состояния (дистилляция, нагревание раствора выше критической точки (350°С), заморозка, газогидратная методика);
- с сохранением жидкой водной фазы (электродиализ, ионообменный метод, экстрагирование, обратный осмос).
При показателе общей минерализации 1,6 – 2,1 г/л рекомендуется применять ионообменный метод обессоливания, более 9 г/л – дистилляцию, замораживание или обратный осмос, 2,3 – 12 г/л – электродиализ, гиперфильтрацию.
Одним из эффективных и удобных в применении методов снижения солесодержания воды является обратный осмос. Водные растворы проходят через полупроницаемые мембраны, оставляя на них практически все находящиеся в водном растворе вещества. Обратноосмотические установки отличаются простотой обслуживания, хорошей производительностью и экономичностью.
Основные компоненты – насосы и картриджи с полупроницаемыми мембранами. Аппараты могут быть адаптированы для обслуживания предприятий, мест общепита, или представлять собой компактные установки для снижения солесодержания в специальном помещении или квартире под раковину.
В качестве исходного сырья для производства мембран используют полимеры, пористое стекло, металлизированную фольгу, графит. По типу мембран обратноосмотические установки бывают с плоскими камерами, трубчатыми элементами, полыми волокнами, рулонные. Для опреснения морской воды используют специальные мембраны, способные выдерживать высокое давление.
- Чтобы продлить эксплуатационный срок мембране, следует установить предварительный угольный фильтр для очистки приходящей воды от грубых взвешенных частиц и органических соединений, содержащих Сl. Концентрация примесей на входе в мембрану не должна быть выше 0,55 мг/л.
- Установка минерализующего картриджа позволяет насытить воду потерянными на мембране минеральными компонентами, но в нужном количестве и полезными соединениями Ca, Mg, K, Na.
Сульфатсодержащие сточные воды неизбежно проникают глубоко в почву. Поэтому в водоносных слоях, откуда жидкость добывается через пробуренные скважины, они всегда присутствуют – более того, являются неизменным компонентом подземных вод. Особенно много их там, где вблизи расположены:
- Очистные сооружения по обработке стоков реагентами, где на выходе образуются сульфат-ионы в воде.
- Предприятия горнодобывающей промышленности.
- Подземные шахты.
- Целлюлозно-бумажные фабрики.
- Нефтеперерабатывающие комбинаты.
- Заводы по изготовлению минеральных удобрений.
Перед употреблением нужно исследовать воду в лаборатории, чтобы точно знать концентрацию сульфатов в воде. Изучив показатели, можно точно подобрать систему очистки, с помощью которой из скважины или из колодца будет подаваться чистый водный раствор, абсолютно безопасный для применения.
Повышенное солесодержание в котловой и питьевой воде доставляет трудности использования этой воды. Для опреснения морской воды и получения дистиллированной применяют обратный осмос. Мы готовы предоставить установки обратного осмоса различной комплектации, мощности и производительности. Подбор картриджей осуществляем исходя из физических и биохимических показателей проб воды, взятых с объекта, после проведения соответствующих анализов.
Чем полезны сульфаты в питьевой воде
Сульфатные минеральные воды с определенным целебным составом используются на бальнеологических курортах для лечения некоторых заболеваний под строгим надзором врача:
- для снижения желудочной секреции;
- для усиления перистальтики кишечника;
- для нормализации стула;
- для избавления от метеоризма.
Очистке ЖКТ способствует сульфат магния, который при концентрации более 100 мг/л, действует как слабительное. Горькие сульфатные воды с высокой концентрацией увеличивают ток желчи, которая помогает вывести из организма токсины, вредные вещества, шлаки, продукты распада.
Сухой остаток показывает суммарное содержание в воде растворенных минеральных и органических веществ. Увеличение значения этого показателя свидетельствует о повышенной вероятности появления взвеси либо выпадения осадка.
Минеральный состав воды определяется концентрацией и соотношением растворенных в ней солей, т.е. содержащихся неорганических катионов и анионов. В практическом применении большое значение имеют катионы H+, Ca2+, Mg2+, Fe2+, Fe3+, K+, Na+, Mn2+, Al3+, Cu2+ и анионы OH-, Cl-, SO42-, HCO3-, SiO32-, PO43-, NO2- и NO3-.
Требования к минеральному составу воды определяются отраслевыми технологическими регламентами, так как присутствие и концентрация солей отражается на скорости протекания технологических процессов и отдельных стадий производства.
Оценить солесодержание можно прокаливанием выпаренного содержимого пробы воды, когда органические соединения распадаются, и остается чистая минеральная составляющая осадка.
Минеральная водоподготовка
Повышенная минерализация воды способствует обрастанию трубопроводов и оборудования отложениями кальциевыми и магниевыми солями. Дорогая бытовая техника, контактирующая с высокоминерализованной водой, требует частой очистки, а без должного ухода выходит из строя. Ежедневное употребление воды, насыщенной солями, воздействует на человеческий организм не лучшим образом.
Очистка
В ходе водоподготовки минерализацию воды снижают:
- дистилляцией;
- электромембранной очисткой (электродиализом);
- баромембранным методом (обратным осмосом).
Дистилляция
Суть метода заключается в испарении жидкости при нагревании и последующем ее конденсировании. Чистая вода закипает при 100 ⁰С, затем испаряется, а примеси с другой температурой кипения остаются на стенках испарителя.
Метод непопулярен из-за высокой энергоемкости процесса дистилляции и неизменного нарастания «шубы» из накипи на нагревательных элементах дистиллятора.
Электродиализ
Ионы металлов и кислотных остатков способны двигаться под действием электрического тока в направлении противоположно заряженных электродов. На этой способности основано обессоливание воды методом электродиализа в специальной емкости, разделенной двумя мембранами на три секции. В крайних секциях расположены электроды, которые притягивают к себе заряженные ионы. Катионы и анионы из межмембранного пространства проходят через мембраны к электродам и собираются там, а в межмембранном пространстве остается вода с пониженным уровнем минерализации.
Обратный осмос
Эффективный и экономически выгодный метод удаления солей из воды – обратный осмос. В основе обратноосмотического фильтра – полупроницаемая мембрана, задерживающая практически все примеси, но беспрепятственно пропускающая воду. Минерализованная вода подается на мембрану под давлением, которое создается специальным повысительным насосом. Вода на выходе из фильтра очищается от солей практически на 100 %, при этом неизбежно становится безвкусной.
Поэтому следующим этапом подготовки высокоочищенной воды становится насыщение ее необходимыми минералами.
Обогащение
Процесс обогащения воды минералами происходит в минерализаторе – картридже с насыщенным раствором солей. Минерализатор восстанавливает водно-солевой состав очищенной воды, улучшая ее вкус. Небольшие дозы ионов кальция, магния, натрия подаются в очищенную воду, приближая ее по уровню растворенных солей к природной.
Удаление сульфатов из питьевой воды
Растворенные сульфаты не удаляются из воды обычными “домашними” методами: кипячением, отстаиванием. Очистка воды от сульфатсодержащих солей проводится комплексно. Она направлена на снижение общего солесодержания в растворе. Компания “Диасел” может предложить бытовые и промышленные установки по качественному обессоливанию и умягчению воды.
Лучшие методы очистки воды от сульфатов:
- Ионный обмен с использованием специальных анионитных смол.
- Обратный осмос с применением мембранных фильтров тонкой очистки.
Как снизить содержание сульфатов в питьевой воде, читайте в нашей следующей статье, где лучшие методы очистки воды от сульфатов описаны более подробно.
Как определить сульфаты в воде
В домашних условиях определение сульфата в воде не вызывает затруднений. Если концентрация солей 250-400 мг и выше на 1 литр, то жидкость неприятно пить из-за соленого вкуса. При превышении нормы в 500 мг вкус становится горьковатым. Сульфатная жидкость провоцирует кишечные расстройства. Ухудшаются её органолептические свойства по сравнению с обычной питьевой водой, пригодной для бытовых нужд. Соли придают водным растворам некарбонатную жесткость, которая не удаляется при высокой температуре – вода остается неприятно жесткой даже при длительном кипячении и выпаривании.
Лабораторное определение сульфатов в питьевой воде позволит более точно установить показатели и сравнить их с допустимыми параметрами. В сертифицированную лабораторию можно сдать на анализ воду из любых источников:
- из колодцев и скважин;
- из централизованного водопровода;
- родниковую;
- из открытых местных водоемов;
- бутилированную;
- технологическую;
- сточную.
Сточные и канализационные воды тоже стоит проверять, если они проникают в почву фермерских полей или в водоемы, из которых берутся водные растворы для разных нужд.
В большом количестве сульфаты серы добавляют в промышленные товары – в косметику, в бытовую химию, что вместе с водой увеличивает концентрацию их поступления в организм. Если сложно выбрать косметические средства без подобных добавок, то хотя бы нужно снизить их присутствие в воде, которой вы ежедневно пользуетесь. Соли вредны не только для людей, но и для природы. Те, кто вносит посильный вклад в экологию, выбирают шампуни, зубные пасты, гели и иные составы без сульфатных добавок.
Интересные факты
Многие столетия вода считалась простым веществом. В 1783 году химик Лавуазье смог разложить воду на два вещества и предположить количественное их соотношение в молекуле.
В обычных условиях вода не имеет ни вкуса, ни запаха. Вода бесцветна, но при толщине более 2 метров она приобретает голубой цвет. Это происходит благодаря рассеиванию коротких лучей солнечного спектра.
Вода – сильный поглотитель солнечной энергии. У воды есть замечательное свойство – медленно нагреваясь, она и медленно остывает. Мировой океан планет накапливает тепло летом и отдаёт его зимой. Так сглаживаются скачки температуры на планете. Суточные и сезонные колебания температуры уменьшаются вблизи водных объектов. Чем меньше в той или иной местности крупных водоемов, тем более резкоконтинентальный там климат.
Серная кислота очень опасна (2 класс опасности). Легко отравиться 10-процентным серным раствором, а более концентрированный состав вызовет ожоги и повреждения внутренних органов. Сульфатные соли менее опасны (4 класс опасности) из-за относительно невысокой концентрации. Они заметно понижают органолептические показатели питьевой воды: вкус, цвет, запах. Вода имеет ярко выраженный солёный привкус с горчинкой, её неприятно пить.
Чем опасны сульфаты в питьевой воде? Переизбыток сульфатных соединений заметно ощущается людьми. Насыщенный концентрированный раствор:
- Раздражает пищевод, ЖКТ.
- Влияет на желудочную секрецию.
- Нарушает процесс пищеварения.
- Препятствует всасыванию пищи.
- Вызывает расстройство кишечника.
- Раздражает слизистые оболочки носа, рта, глаз.
- Провоцирует аллергический зуд, воспаления кожи и прочие симптомы аллергии.
При смене места жительства, при переезде в местность, где вода содержит много сульфатсодержащих солей, приезжие будут долго страдать от расстройства кишечника, пока организм не привыкнет и не перестроится. Или до тех пор, пока пользователи не начнут очищать воду перед употреблением.
Наличие сульфатов в воде с избыточным присутствием ионов кальция способствует образованию толстого слоя накипи, которая сужает просветы трубопроводов, разрушает гидротехническое оборудование. Неочищенные сульфатные водные растворы нельзя подавать в паросиловые установки, в водогрейные и паровые котлы. При прохождении через свинцовые водопроводы сульфатсоли вымывают свинец, повышают его концентрацию в питьевой воде.
Охрана воды
Человек в результате своей деятельности может испортить источники воды. Если сбрасывать мусор в реку, то вода в ней может стать непригодной для питья. Поэтому существуют законы, которые защищают водные ресурсы. В частности, они требуют, чтобы промышленные предприятия фильтровали те отходы, которые они всё же вынуждены сбрасывать в реки.
Запасы пресной воды на Земле
- Ухудшающаяся с каждым годом экологическая ситуация на планете, истощение ресурсов, загрязнение окружающей среды – обо всем этом мы слышим каждый день, и уже не оцениваем как реальную опасность. Однако положение с водными ресурсами действительно критическое, и если энергию можно получить от ветра и солнца, то откуда брать пресную воду, без которой не обойдется ни один живой организм? Сколько процентов пресной воды на земле, и как надолго ее хватит (если хватит всем) – остро стоящий вопрос для ведущих экологических институтов мира.Что считается пресной водой и входит в ее ресурсыВся вода на поверхности планеты и в верхних слоях земной коры – мировой океан, лед на вершинах гор и полюсах, подземные воды, – образует гидросферу планеты. Это 1,4 млрд м. куб. Но лишь малая часть этого количества подходит для употребления человечеством. Пресная вода в гидросфере земли – это ледники, реки, озера, не содержащие соли, а также пары атмосферы.Установлено, что доля пресной воды на земле составляет лишь 2,5% от общего количества воды. Звучит немного пугающе. Но при этом средний запас питьевой воды на каждого человека – примерно 6 олимпийских бассейнов. И это уже обнадеживающе, однако распределена вода неравномерно на континентах мира.В какой из стран больше всего запасовЛидирует в списке стран с самыми большими запасами пресной поверхностной воды на земле Россия. Около 80% находится в озере Байкал (это около 20% мирового резерва воды, пригодной к употреблению). Таким образом, перспективной Россию делают не запасы нефти и газа, а обычной питьевой воды, без которой человечество не выживет.Согласно данным аналитиков, через 20 лет около 4 млрд человек в мире будут страдать от постоянной нехватки пресной воды. На сегодняшний день острый дефицит питьевой воды отмечен у 780 млн. жителей планеты, 40% из которых – африканцы. И еще для 1,9 млрд. людей питьевая вода для повседневных нужд доступна в недостаточном объеме.С учетом того, что к 2050 г. население планеты увеличится до 9 млрд., воды для питья понадобится на 70% больше, а для приготовления пищи – на 20%. Для справки: чтобы получить по килограмму пшеницы и мяса требуется примерно 15 тыс. тонн не соленой воды.Количество пресной воды на земле ограничено, и скоро станет еще меньше. Кто-то ассоциирует конец света с падением метеорита, ядерной войной, неизлечимыми вирусами. Но основная причина значительного ухудшения качества жизни на Земле, и даже ее полного прекращения, может быть куда банальнее. А разрешить ее намного сложнее. Задумайтесь об этом, и рационально относитесь к водным ресурсам – нашему будущему.
- Вам будет интересно
• Можно ли пить воду из родника• Почему вода мутнеет при кипячении• Применение минеральной воды при лечении• Можно ли пить воду сразу после бега
Откуда берутся растворенные в воде сульфаты
Образованию сульфатных солей способствуют сульфатредуцирующие бактерии. Чаще всего сульфаты имеют осадочное происхождение – это морские и озерные осадки.
Из-за способности солей к растворению сульфатные соединения попадают в воду:
- При выветривании и вымывании осадочных и вулканических пород.
- При отмирании живых организмов: растений, животных.
- За счет окисления сульфидов серы.
- При выпадении природных осадков.
- При таянии льда, града, снега.
- Из-за растворения серосодержащих минеральных кристаллов типа гипса, ангидрида, алунита.
Сульфат калия присутствует в озерах. Сульфаты магния из гололедных реагентов попадают в природные воды через ливневые стоки. Часто сернокислые соли образуются при разнообразных технологических процессах. Они проникают в почву вместе с промышленными, техническими, канализационными стоками, в которых содержание сульфатов намного выше ПДК (предельно-допустимой концентрации солей). Загрязненные производственные отходы поступают из шахт добычи руды или из гальванических цехов, где используется серная кислота. Сульфатные соединения серы проникают в грунт со стоками фермерских хозяйств и с бытовыми жидкими отходами.
Состав воды
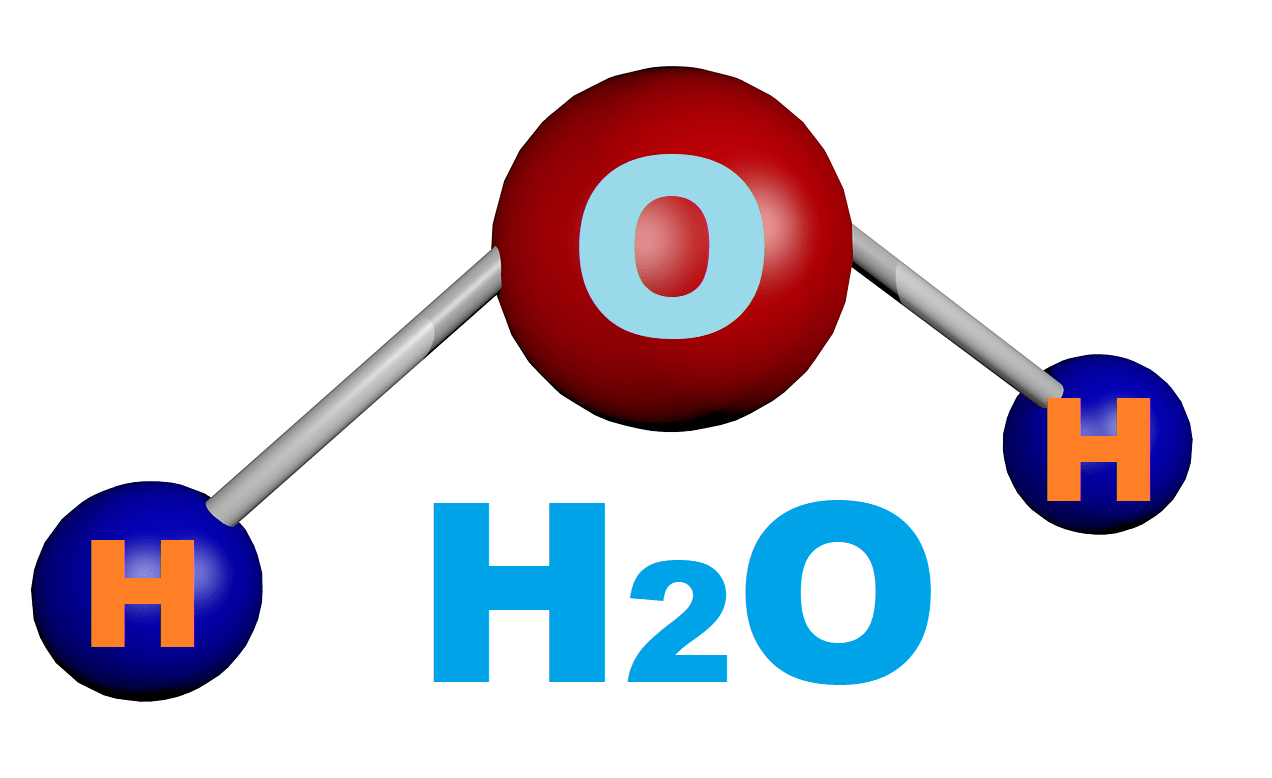
Схема структуры молекулы воды
Молекула воды (H2O) складывается из 2-х атомов водорода и 1-го атома кислорода. Это два газообразных вещества, которые, соединяясь, образуют невероятно прочные связи. Главную роль в молекуле выполняет атом кислорода. Атомы водорода несут положительный заряд, а атом кислорода – отрицательный. Каждый из атомов водорода, крепко держась в образованной молекуле, одновременно притягивается к атому кислорода из соседней молекулы. Связи кислорода и водорода из соседних молекул гораздо слабее, чем внутри. Благодаря этим межмолекулярным связям, вода обладает рядом удивительных свойств.
Какой воды на земле больше
- Наша планета имеет большие залежи воды, она занимает около 70 % от всего ее объема. И только 3 % составляет пресная вода, которую мы употребляем. Несмотря на то, что регулярно выпадают осадки, наблюдаются испарения, объем постоянно находится на одном уровне, он не меняется, является постоянной величиной. Но все же стоит выяснить, какой воды на земле больше, рассмотреть виды и показатели.Что такое пресная вода и источникиК пресной относится вода, которая имеет в основе 0,1 % соли. Ее объем небольшой, показатели держатся на уровне 2,5-3 %. Из этого запаса для людей используется 1 %, а остальное имеется в составе ледников, айсбергов.
Среди источников можно выделить:
• Ледники. В их составе имеется до 70 % мировых запасов;
• Слои под землей. В них наблюдается до 30 %;
• В составе озер, водохранилищ содержится 0,6 %;
• В почве сохраняется 0,3 %;
• В составе атмосферы распределено до 0,06 %;
• Реки. В них имеется 0,04 %.Пресная вода относится к возобновляемому ресурсу, и за счет круговорота происходит ее перемещение и перераспределение, но главное что она не исчезает.Запасы на землеБольший объем пресной воды нельзя пить без проведения обработки. Она должна пройти требуемую очистку от разных минералов, осадков, вредных веществ, которые могут скапливаться при эрозии.
Примерное распределение залежей жидкости на планете:
• 90,4 % приходится на мировой океан;
• В основе ледников, снега имеется до 1,87 % залежей;
• В подземных источниках содержится 1,7 %;
• В реках, озерах, других водоемах на суше имеется около 0,02 % запасов;
• В составе живых клеток, атмосфере наблюдается 0,02 %.Гидросфера имеет большую толщину, ее показатель составляет 4 км. Если бы почва обладала песчаной структурой, то жидкость не задерживалась на поверхности. Удерживание происходит за счет глинистой земли. Глиняная почва при набухании образует водяной замок, он не пропускает жидкость. Согласно подсчетам ученых было установлено, что в составе почвы имеется в 10-12 раз больше жидкости, чем в основе мирового океана, но большая ее часть непригодна для употребления.
Так какой воды на земле больше – пресной или соленой? Выше было указано, что пресной мало, ее объем 3 %. А вот 94 % приходится именно на соленую – моря, океаны, озера, реки. Что касается пресной, то она не вся доступна для человека, основной ее объем сосредоточен в ледниках, полярных районах, высоко в горах.
Кроме этого, пресная вода распределена на земле неравномерно. Поэтому около 2/3 населения планеты испытывают в ней недостаток, а 1/3 населения остро в ней нуждается.Мировые запасыНа Земле насчитывается до 35 миллионов кубических литров жидкости, которую можно использовать для питья, для сельскохозяйственных нужд, промышленности. Показатель объема запасов низкий, если сравнивать с соленой водой – 2,8 % против 97,2 %.Показатели объема пресной воды в разных странах имеют различия. Среди лидеров можно выделить:
• Бразилия. В этой стране наблюдается до 6 900 км3;
• Россия. На ее огромной территории сосредоточено до 4 500 км3;
• США. Здесь имеются запасы 3080 км3;
• Канада. Имеются залежи в размере 2 900 км3;
• Китай. В стране сосредоточено до 2 800 км3.В составе атмосферыНа Земле основной объем жидкости имеет газообразное состояние. Согласно исследованиям были установлены примерные показатели – 14 000 км3. В составе атмосферы вода формируется при испарении, разносится по земле при помощи воздушных масс. Из пара жидкость может выделяться в разных видах – снег, град, дождь.Пар из влаги в атмосфере образует покрывало с защитными функциями. Он обеспечивает деятельность живых организмов. Пар забирает основной объем инфракрасного излучения, поддерживает тепло ночью. При выделении тепла происходит конденсация, таяние. А вот замерзание и испарение связаны с теплопоглощением.Свойства пресной водыПресная вода обладает качествами:
• Показатель жесткости связан с ионами магния и кальция. Чем выше содержание данных веществ, тем больше жесткость жидкости;
• Кислотность. Она зависит от показателей водорода;
• Запахи придают жидкости газы, включения нефти, субстрат. Это свойство оценивается максимум в 5 баллов;
• Вкусовые качества определяются от 1 до 5 баллов. По вкусу жидкость может быть соленая, горькая, кислая, сладкая;
• Показатели прозрачности устанавливают по шкале, которая состоит из 14 делений.Пресная вода располагается на разной глубине от поверхности земли, и ее источники возобновляемые. В зависимости от глубины бывают артезианского, межпластового и грунтового вида.
Пресная вода, которая реализуется нашей компанией, добывается на больших глубинах в местах с высокой экологичностью. Она фильтруется естественным способом, мы не проводим ее очистку специальными смесями и веществами. В ее основе нет хлора, вредных элементов. Нашу продукцию могут заказать частные лица и компании.
- Вам будет интересно
• Типы питьевой воды• Живительная влага• И еще раз о воде• Обогащенная кислородом вода
Гидросфера
Гидросфера – это вся вода, находящаяся на нашей планете. В ее состав входят:
- различные водоемы (океаны, моря, реки, озера, водохранилища);
- подземные воды;
- ледники;
- снег;
- вода, находящаяся в атмосфере.
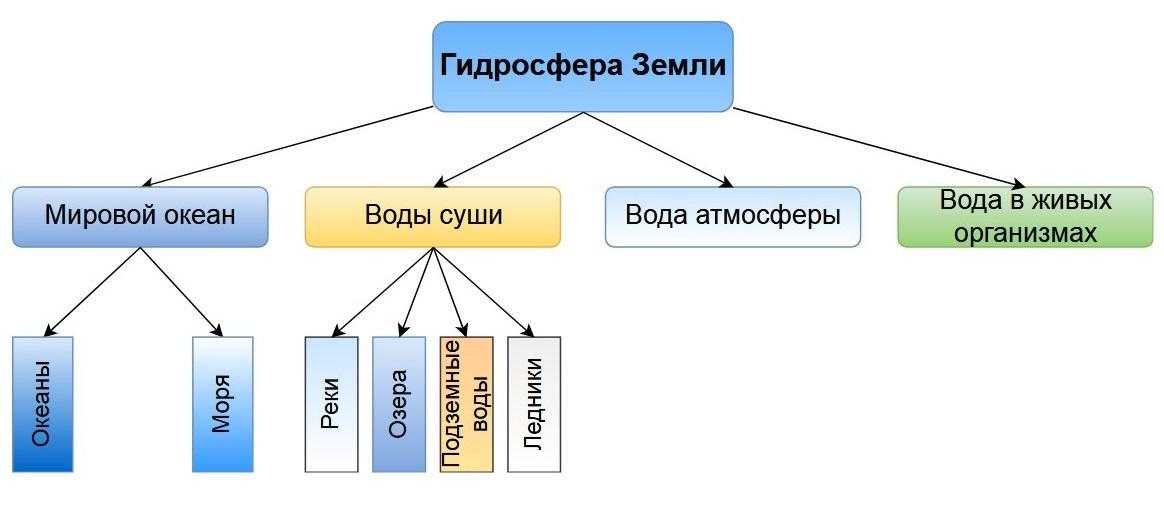
Схема гидросферы Земли
Водные богатства – это источники воды, которые могут быть использованы для хозяйственной деятельности. Проще всего получить воду из водоемов. Однако при их отсутствии используют и другие источники. Например, минеральную воду часто добывают, буря в земле так называемые артезианские скважины, через которые можно получить доступ к подземным водам.
Сульфаты в воде – вред и польза
Сернокислые соли чем-то вредны, чем-то полезны. Разберем пользу и вред на примере шампуней. Бытовые и промышленные моющие составы с сульфатными добавками поверхностно-активных веществ (ПАВ) разрыхляют структуру волос. Хорошо вымывают из них грязь, красящие пигменты, силикон, химические средства, применяемые для завивки или укладки. Придают волосам пышность, объем. Для изготовителей это недорогой компонент, заметно улучшающий потребительские свойства их продукции.
Шампуни с сульфатами:
- Отменно промывают волосы в любой воде.
- Хорошо пенятся, малозатратны в использовании.
- Без остатка смывают лаки, гели.
- Предотвращают появление перхоти.
Самая безопасная добавка SLES – лауретсульфат натрия. Более агрессивно действует SLS (лаурилсульфат натрия) и особенно вредны соли аммония ALS и ALES (лаурилсульфат и лауретсульфат). Они опасны тем, что вымывают природный кератин, через кожу головы и рук легко проникают во внутренние органы. По мнению исследователей, присутствующий сульфат серы в воде переносит из неё в кровь все тяжёлые металлы, постепенно отравляя организм.
Нельзя длительное время мыть волосы шампунем и водой с сульфатными солями, если волосы тонкие, секущиеся, выпадающие; если кожа головы слишком раздражается при воздействии. Вредно использовать шампуни с сульфатными ПАВ после сложных парикмахерских процедур: тонирования, окраски, мелировки; после ботокса, укладки, химической завивки. У чувствительных людей сульфаты в водопроводной воде и в шампунях могут сильно раздражать кожу, вызвать аллергические реакции, онкологию, обильное выпадение волос вплоть до полного облысения.
Присутствие сульфатных солей в моющих средствах помогает хорошо вымыть посуду даже в холодной воде, без проблем удалить моторное масло с деталей автомобиля. Они обеспечат качественное обезжиривание, но при этом сильно сушат кожу рук при длительной работе и наносят вред экологии.
Вода бывает пресная и соленая. В соленой воде растворено много солей, поэтому ею нельзя утолять жажду. Здесь стоит уточнить, что и в пресной воде может быть соль, но ее очень мало. Особо выделяют дистиллированную воду – эта вода, специальным образом очищенная от примесей. Она имеет некоторые особые свойства, но также пригодна для питья.
Соленую воду часто называют морской, потому что именно такая вода находится в океанах и морях Земли. Океаны – это крупнейшие водоемы планеты. Всего на нашей планете есть 4 океана:
- Тихий;
- Атлантический;
- Индийский;
- Северный Ледовитый.
Впрочем, некоторые ученые выделяют ещё и Южный океан, омывающий Антарктиду.

Вид на море
Моря – это крупные водоемы, входящие в состав океанов. Всего на Земле выделяют более 60 морей.
Все моря и океаны объединены в один огромный водоем, который именуют Мировым океаном. Из одной точки Мирового океана в любую другую его точку всегда можно проплыть, не выходя на сушу.
Морская вода может находиться и в некоторых озерах. Озеро – это изолированный водоем, который напрямую не связан с Мировым океаном. Заметим, что из озера может вытекать река, которая впадает в Мировой океан. Однако так как река течет в одном направлении, то вода из океана не может попасть в озеро, и поэтому оно считается изолированным водоемом.

Каспийское море – крупнейшее соленое озеро на Земле
Крупнейшие соленые озера часто называют морями. Это Каспийское море, Аральское море, Мертвое море. Если в Мировом океане соленость воды примерно одинакова, то у озер она может сильно отличаться. Например, соленость озера Баскунчак почти в 8 раз выше, чем у океанской воды. Поэтому вблизи соленых озер часто организуют добычу соли.
Подведение итогов
В океанах и морях находится соленая вода, непригодная для питья. Пресной воды значительно меньше, чем соленой, и получают ее из рек и озер, хотя существуют и соленые озера.












