Бесцветный газ с неприятным запахом тухлых яиц. Также является побочным продуктом нефтепереработки
- Общая характеристика
- Области применения
- Влияние сероводорода на организм человека
- Получение H2S
- Сероводород в окружающей среде
- Общее описание
- Физические характеристики
- Химические свойства
- Соли кислоты
- Получение вещества
- Вред сероводорода
- Применение дигидросульфида
- В нормальном состоянии
- При патологических изменениях
- Использование при анабиозе
Общая характеристика
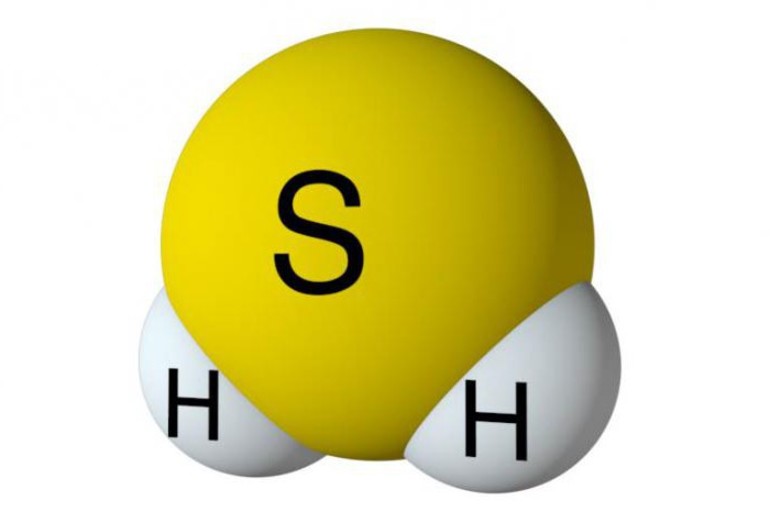
Сероводород (сернистый водород, сульфид водорода, дигидросульфид) H2S – самое активное из серосодержащих соединений.
В нормальных условиях – бесцветный газ с неприятным запахом тухлых яиц.
Газ – потому что атомы водорода в молекуле не образуют прочных водородных связей, в отличие от молекул воды,.
Растворим в воде (в 1V H2O растворяется 3V H2S при н.у.), растворяется в этаноле.
Растворимость H2S в углеводородной фазе выше, чем в водной, коэффициент распределения H2S между фазами зависит в 1ю очередь от состава углеводородной фазы: в бензоле – 5 9 – 6 0; в керосине – 2 4 – 2 5; в легкой нефти – 1,5 – 1,75.
Взрывоопасен в смеси с воздухом в диапазоне 4 – 45% об.
Вызывает сильную коррозию металлов.
Также является продуктом нефтепереработки.
Области применения
Используется в химической промышленности в оргсинтезе для получения тиофена и меркаптанов, получения серы, серной кислоты, сульфидов.
В медицине используется в сероводородных ваннах.
Влияние сероводорода на организм человека
Сероводород – токсичный газ 3 класса опасности, действующий непосредственно на нервную систему.
Сероводород притупляет обонятельный нерв и интоксикация может произойти внезапно.
Ощутимый запах – при концентрации H2S 1,4 – 2,3 мг/м3, значительный запах – 4 мг/м3, тяжелый запах – от 7 мг/м3.
Острое отравление наступает уже при концентрациях 0,2 – 0,3 мг/л, концентрация более 1 мг/л ( 0,1% концентрация газа в воздухе) – смертельна для человека.
Признаки сильного отравления сероводородом: отек легких, судороги, паралич нервов, последующая кома.
Если в содержится от 0,02% H2S, то ощущается головокружение, головная боль, тошнота и довольно скорое привыкание к запаху тухлых яиц.
При хроническом отравлении ухудшается зрение, поражается слизистая оболочка глаза, вероятен конъюнктивит, светобоязнь.
При отравлении H2S, нужно срочно выйти на свежий воздух, принять сердечные и дыхательные аналептики, препараты железа, глюкозу, витамины.
Предельно-допустимая концентрация (ПДК) H2S в воздухе в рабочей зоне – 10 мг/м3 (ГН 2.2.5.1313-03 Предельно допустимые концентрации вредных веществ в воздухе рабочей зоны), в смеси с углеводородами – 3 мг/м3.
ПДК H2S в воздухе населенных мест- 0,008 мг/м3 (ГН 2.1.6.1338-03 Предельно допустимые концентрации загрязняющих веществ в атмосферном воздухе населенных мест).
Получение H2S
– реакция взаимодействия разбавленных кислот с сульфидами
– реакция взаимодействия сульфида алюминия с водой
– сплавление парафина с серой.
Сероводород в окружающей среде
В природе встречается довольно редко в составе попутного нефтяного газа (ПНГ), природного газа, вулканического газа, в растворенном виде в природных водах.
К примеру, в Черном море слои воды, расположенные глубже 150 -200 м содержат растворенный H2S.
Содержится в сырой нефти.
Образуется при гниении белков, содержащих в составе серосодержащие аминокислоты метионин или цистеин.
Кишечные газы человека и животных тоже содержат H2S. Чуть – чуть, но малоприятно.
Общее описание
Вещество в природных условиях встречается в смеси нефтяных газообразных углеводородов, содержится в составе вулканических выделений. В водной среде находится в форме раствора, например, в Черном море содержится в толще воды на глубине более 200 м. Гидросульфит выделяется в процессе разложения белков, которые имеют в составе цистеин или метионин (аминокислоты с содержанием серы). Малое количество сернистого водорода выделяется из кишечных газов животных и человеческих организмов.
Физические характеристики

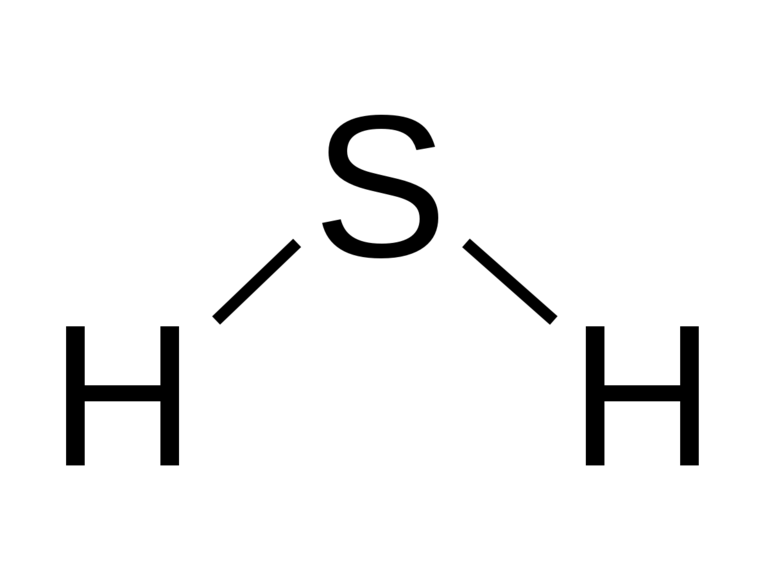
Вещество относится к термически устойчивым соединениям в агрегатном состоянии, при повышении температуры свыше +400ºС разделяется на простые компоненты — Н2 и S. Молекула вещества представляется в изогнутой форме и отличается полярностью (μ = 0,34. 10-29 Кл.м). Водороды не обнаруживаются в дигидросульфидах, в отличие от воды, поэтому в нормальных условиях вещество в жидкое состояние не преобразуется.
Физические свойства сероводорода:
- При растворении дигидросульфида в водной среде получается малая по силе сероводородная кислота, которая становится сверхпроводником при понижении температуры до -70ºС и показателе давления 150 ГПа.
- В жидком состоянии H2S обладает сниженной электропроводимостью, по сравнению с водной средой, так как сернистый водород отличается слабой диэлектрической проницаемостью. В таком виде соединение получает свойства органического раствора, который почти не растворяет лед.
- Твердый дигидросульфид отличается плотностью молекулярного строения, при этом у всех частиц есть 12 расположенных рядом соседей (связи явно различаются со структурным сцеплением льда).
- Плавится серный водород при показателе 2,5 кДж/моль, а испаряется в случае достижения условий 18,7 кДж/моль.
- Вещество весит больше воздуха и подвергается сжатию при достижении температуры -60,2ºС. Полное сжатие проходит при -85,7ºС.
В воздушной среде происходит горение вещества с образованием воды и серного диоксида, реакция выражается уравнением: 2H2S + 3O2 = 2SO2 + 2H2O. Если в огонь поместить холодный твердый предмет, то окисление идет до свободной серы, которая образует остаток желтого цвета: O2 + 2H2S = 2S + 2H2O. Чтобы растворить 2,5 объема сернистого водорода, потребуется всего 1 объем жидкости, при этом раствор будет называться сероводородной водой. Смесь становится мутной при содержании на воздухе и на свету, так как происходит кислотная реакция между гидросульфидом и воздухом.
Химические свойства
В результате охлаждения насыщенного раствора можно получить кристаллогидрат H2S . 6H2O. Растворимость сероводородного компонента в органике происходит более активно, чем в воде. В одной порции спирта растворяется 7 частей сероводорода. Интенсивность растворимости достигает максимума при температуре 350ºС, что объясняется получением полисульфидов.
В воде вещество окисляется йодом с выделением свободной серы, а в газовой среде сера окисляет йодистый водород до появления свободного йода по схеме:
- I2 + H2S = S + 2HI.
- S + 2HI = I2 + H2S + 6 кДж.

В газово-воздушной среде при температуре ниже -50ºС образуется молярное соединение H2S . I2. Константа диссоциации сероводородной кислоты слабее угольной, децинормальная смесь имеет кислотность pH = 4.1. Сера с водородом не вступает во взаимодействие в обычных обстоятельствах, только при увеличении температуры идет реакция: S + H2 = H2S + 21 кДж.
Химические свойства сероводорода позволяют выступать ему в качестве восстановителя, примером служит список реакций:
- Br 2 + H 2 S-2 = 2HBr + S0.
- 4Cl 2 + 4H 2 O +H 2 S-2 = H 2 S + 6SO 4 + 8HCl.
- 2FeCl 3 + H2S-2 = S0 + 2FeCl 2 + 2HCl.
Серебро получает черный оттенок, если реагирует с сероводородом, что является результатом взаимного влияния растворимых сульфидов и дигидросульфидов в химии. Средние соли с содержанием аниона S2- носят название сульфидов, а кислые массы с анионом HS относятся к классу гидросульфидов. Соли имеют различную цветность, несмотря на то, что ионы являются бесцветными. Сульфиды в воде почти не растворяются, а гидросульфиды реагируют и образуют водные растворы.
Соли кислоты
Вещества растворяются в воде, если находятся в таблице щелочных металлов. Остальные соединения подобного типа не взаимодействуют с водой. Сульфиды выпадают в осадок в результате реакции гибридизации, когда вводятся металлические соли или соль сероводородной кислоты.
У щелочноземельных и щелочных металлов есть гидросульфиды М2+(Н S)2 и M+ HS. Нестойкими являются гидросульфиды Ca2+ Sr2+ . Растворимые сульфиды героизируются в воде, так как относятся к слабым солям кислоты. Часто такая реакция является необратимой с появлением осадка в виде нерастворимого гидроксида.
Получение вещества
Практическое получение сероводорода проходит в реакции сульфида железа и разбавленных кислот. Другим удобным методом является нагревание сплавленной серы в виде порошка до 170ºС в сочетании с частицами асбеста и парафином. Концентрация смеси составляет 3:2:5, соответственно. В охлажденном состоянии взаимодействие прекращается, а активизируется реакция с повышением температуры.
Начальный сплав заготавливается заранее и расходуется в случае необходимости, при этом 1 г дает 150 г сероводорода. Для получения чистого вещества смесь пропускается вместе с серными парами над разогретыми глыбами пемзы, при этом температура равняется 100ºС, а давление составляет 90 атм. Температурная диссоциация сероводорода наступает при 400ºС и достигает апогея при достижении 1700ºС.
Вред сероводорода
Взрывоопасной является смесь вещества с воздухом, при этом температура 300ºС ведет к воспламенению и дальнейшему взрыву в случае содержания 5−46% H2S. Ядовитость вещества часто недооценивается и деятельность с ним без защитных средств ведет к отравлению. Всего 0,1% концентрация сероводорода в атмосфере помещения вызывает неприятные последствия для организма.
После вдыхания сероводородных паров наступает потеря обоняния, затем обморок или паралич дыхания, что ведет к смерти человека. Помогает быстрое удаление пострадавшего из проблемного помещения. Симптомами отравления является головная боль, нарушение сознания и тошнота. Иногда обмороки наступают позднее, когда человек уже не работает с газом. Средства защиты необходимы, при этом требуется тщательно запахнуть респираторы и другие предметы предохранения.
Применение дигидросульфида
Сероводород в качестве сульфидов используется в технике, например, с его применением изготавливаются люминофоры, полупроводники. В этом производстве задействуются сульфиды кадмия и цинка. В качестве основы смазок берется дисульфид молибдена.
Польза от применения сероводорода:

- в области неорганической химии вещество применяется в качестве реагента для выделения осадка тяжелых металлов, если их сульфиды относятся к категории слаборастворимых;
- в медицине используется в виде искусственных и природных ванн и вводится в состав минеральных вод;
- серный водород участвует в производстве сульфидов, элементарной серы и серной кислоты;
- используется в синтезе меркаптанов и тиофена.
В последние годы рассматривается возможность применения вещества из глубин моря. Его планируется использовать в области сероводородной энергетики в виде химического и электронного сырья.
В нормальном состоянии
Эндогенный дигидросульфид в небольшой массе производится клетками живых организмов и является важным компонентом многих биологических действий. Вещество является третьим из найденных ранее трансмиттеров после угарного газа и азотной окиси. Этот тип соединения выделяется в организме с помощью цистеина и относится к группе спазмолитиков и вазодилататоров. Он активно действует на ЦНС, повышает трансмиссию нейронов и способствует функционированию памяти.

Впоследствии вещество окисляется до ионов сульфитов в митохондриях с помощью тиосульфат-редуктазы, затем превращается в ионы сульфатов при воздействии специального фермента. Из организма в конечном виде выводится мочевыми протоками.
В организме человека эндогенный сероводород считается важным фактором для защиты от заболеваний сердца и сосудов, благодаря аналогичности со свойствами азотной окиси. Несмотря на схожесть, действие сероводорода и оксида азота различаются, хотя они оба оказывают кардиопротективное действие. Азот активирует гуанилатциклазу, а дисульфид приводит в тонус чувствительные каналы поставки калия в гладких мышцах.
Исследования показывают, что для поддержания сосудистого тонуса важно сочетание азота, сероводорода и угарного газа. Окись азота в условиях физиологической нормы расширяет крупные артерии и вены, а серный водород отвечает за расслабление периферических сосудов крови. В организме выявляется взаимодействие сигнальных путей азота и сероводорода, что говорит о зависимости спазмолитического, цитопротекторного и противовоспалительного действия газов друг от друга.
https://youtube.com/watch?v=gIwB6a5b6co
В теле человека серный водород реагирует с внутриклеточными ферментами, при этом образуется HSNO (нитрозотиол). Веществу отводится ведущая роль контроля внутриклеточной концентрации энзимов.
При патологических изменениях
В случае инфаркта выявляется дефицит эндогенного сероводородного газа, что негативно сказывается на состоянии сосудов. Сниженная биологическая доступность серного водорода и окиси азота ведет к некрозу мышцы сердца. Дефицит сероводорода способствует высвобождению большого числа радикалов и наступает экссудативный внутриклеточный стресс.
При недостатке серного водорода активность ферментов изменяется и угнетается биологическое воспроизводство азота. В это время применяется сероводородная терапия прекурсорами вещества или донорами, например, диалил-трисульфидами для увеличения содержания газа в крови и мышцах больного. В результате опасность патологии и повреждений сердечной мышцы становится минимальной.

В организме серный водород может запасаться в виде сульфат-серы. Это промежуточный компонент, который образуется при взаимодействии избыточного вещества с кислородом и используется при необходимости. Порции запасного сероводорода вступают в реакцию с кислородом и активизируют выработку азота, что уменьшает число свободных радикалов.
При заболевании Альцгеймера снижается уровень сероводородного компонента в сосудах мозга, как и у пациентов с недугом Паркинсона. Введение прекурсоров вещества дает улучшение самочувствия вплоть до полного избавления от характерных симптомов. При синдроме Дауна, наоборот, содержание сероводорода обнаруживается в очень завышенной концентрации.
Использование при анабиозе
Теоретически и практически доказано, что продукция сернистого водорода у особей, которые впадают в зимнюю спячку, повышается в несколько раз. Дыхание замедляется и составляет около 10 движений в минуту, а температура тела снижается на 2º. На опытах с мышами было установлено, что гипотермия мозга при этом уменьшает повреждение в органе при инсульте или травматическом воздействии.

Если бы удалось воспроизвести такое действие в организме человека, то сероводородная гибернация стала бы полезным открытием в клинике спасения жизней после травм, инсультов и инфарктов, а также для хранения органов от донора.
Исследования показывают, что эндогенный серный водород влияет на скорость метаболизма, регулирует естественным способом уровень обменных процессов. Последние опыты показали, что эффект гибернации не возникает у крупных животных, а развивается исключительно у мышей. Анабиозу с помощью сероводородного компонента нельзя подвергнуть свиней или овец, что было практически доказано. Клинические испытания действия сероводорода на человека в части анабиоза были начаты, но неожиданно прекратились медицинской компанией без объяснения причин.
Сероводород – это бесцветный сжатый сжиженный газ тяжелее воздуха, с характерным запахом тухлых яиц. Чрезвычайно огнеопасно. Может стелиться по земле, возможно возгорание на расстоянии. НЕ ДОПУСКАТЬ открытого огня, искр и курения. Смеси газ/воздух взрывоопасны. Вещество может всасываться в организм при вдыхании.
Сероводоро́д (H2S) — бесцветный термически неустойчивый(при температурах больше 400 °C разлагается на простые элементы), ядовитый газ тяжелее воздуха с неприятным запахом тухлых яиц. Встречается в природе в составе нефти, природного газа, вулканического газа и в горячих источниках. Хороший восстановитель.
Температура плавления: −86 °C (187 K), температура кипения: −60 °C (213 K), молекулярная масса 34,1 а. е. м.. В отличие от молекул воды, молекулы сероводорода не образуют.
Бесцветный газ, немного тяжелее воздуха, мало растворим в воде(сероводородная кислота), является , имеет запах похожий на запах тухлых яиц.
В лаборатории обычно получают действием разбавленных кислот на сульфиды:
FeS + 2HCl = FeCl2 + H2S
Или при добавлении к сульфиду алюминия воды:
(реакция отличается чистотой полученного сероводорода)
На воздухе горит синим пламенем:
2H2S + ЗО2 = 2Н2О + 2SO2
при недостатке кислорода:
2H2S + O2 = 2S + 2H2O
(на этой реакции основан промышленный способ получения серы).
Сероводород энергичный восстановитель:
2H2S + SO2 = 2Н2О + 3S
H2S + I2 = 2HI + S
С основаниями реагирует:
H2S + 2NaOH = Na2S + H2O (обычная соль, при избытке NaOH)
H2S + NaOH = NaHS + H2O (кислая соль, при отношении 1:1)
Является первым членом в ряде — H2Sn (n=1÷8)
Сероводородная вода — насыщенный водный H2S. Очень слабая кислота — K1=6·10-8, K2=1·10-14
Большое значение имеют соли сероводородной кислоты — сульфиды. Сероводород применяют для получения серной кислоты, элементной серы, сульфидов; используют в для получения и , в аналитической химии для разделения элементов путем осаждения сульфидов.
es:Sulfuro de hidrógeno
pt:Sulfeto de hidrogénio









