Le СО бесцветный газ без запаха при нормальной температуре и давлении с плотностью, близкой к плотности воздуха. Он является результат неполного сгорания, Quel независимо от используемого топлива (дрова, бутан, уголь, бензин, природный газ и т. д.), а CO2 возникает в результате полного сгорания.
Во-вторых, что такое СО? Угарный газ (СО) — бесцветный газ без запаха, немного легче воздуха. Его плотность составляет 0,968, тогда как плотность воздуха равна 1. На практике эта разница незначительна, CO почти полностью смешивается с воздухом.
Почему CO более опасен, чем CO2?
Почему угарный газ токсичен для человека? Не раздражает глаза и дыхательные пути. Когда человек вдыхает угарный газ, газ попадает в его кровь и занимает место кислорода. Это повреждает ткани и может быть очень опасным для здоровья.
Итак, ядовит ли углекислый газ? Опасения и опасности
В высоких концентрациях углекислый газ может вытеснять кислород из воздуха, лишая организм кислорода, что может привести к потере сознания. Углекислый газ также действует как мощный депрессант центральной нервной системы.
- СО легко воспламеняется?
- Что такое СО?
- Каковы характеристики СО?
- Чем опасен угарный газ?
- Угарный газ повышается или понижается?
- Какой уровень угарного газа опасен?
- Почему угарный газ ядовит?
- Как выделяется угарный газ?
- Что выделяет угарный газ?
- Как защитить себя от углекислого газа?
- Может ли CO2 взорваться?
- Какой уровень CO2 опасен?
- Является ли CO парниковым газом?
- Как узнать, есть ли у вас отравление угарным газом?
- Когда образуется угарный газ?
- Как угарный газ может убить?
- Что такое неполное сгорание?
- Как образуется СО?
- Химические названия и формула
- Воздействие на организм
- Токсичный газ
- В чем польза угарного газа?
- Химические свойства
- Структура молекулы
- Немного истории
- Окисление монооксида углерода
- Есть ли СО в природе?
- Молекулярные свойства
- Получение
- Основные симптомы и помощь при отравлении СО
- Применение
- Угарный газ и углекислый газ
- Химическая формула угарного газа
- Строение молекулы
- Физические свойства
- Нахождение в природе
- Биологическое действие на организм
- Использование в промышленности
- Разница между оксидом углерода и диоксидом углерода
- Откуда берется углекислый газ?
- Откуда берется окись углерода?
- Риски для здоровья, связанные с оксидом углерода и диоксидом углерода
- Окись углерода, монооксид углерода, угарный газ (СО)
- Окись углерода (угарный газ), как парниковый газ
- Человеческое воздействие
- Диоксид углерода, углекислый газ (CO2)
- Углекислый газ как парниковый газ
- Углекислый газ в прошлом
- Использование лесовосстановления для удаления CO2
- Удаление углекислого газа с помощью гумуса в почве
- Хранение CO2 в земле
- Удаление CO2 применением минералов горных пород
- Способы изготовления
- Использование соединения
- Влияние на живые организмы
- Взаимодействие с другими веществами
- Методы получения
- Применение углекислоты
- Физиологическое действие
СО легко воспламеняется?
Угарный газ является чрезвычайно легковоспламеняющимся газом. Образует с воздухом взрывоопасные смеси в очень широких пределах (от 10,9 до 76% по объему).
Что такое СО?
СО — очень ядовитый, смертельный, бесцветный газ без запаха, образующийся при неполном сгорании углеродосодержащих материалов: угля, нефти, бензина, мазута, газа, древесины. Вдыхаемый угарный газ легко и быстро связывается с гемоглобином в крови вместо кислорода, вызывая отравление.
Каковы характеристики СО?
Характеристики угарного газа
Угарный газ (СО) — удушающий газ, который может привести к летальному исходу. Он простой, без запаха, без цвета, без вкуса и не вызывает раздражения. Его плотность 0.976 очень похожа на плотность воздуха, которая равна 1.0. Поэтому CO быстро диффундирует в окружающий воздух.
Чем опасен угарный газ?
Выше 40 000 частей на миллион: Воздействие этих высоких концентраций вызывает серьезную нехватку кислорода, что может привести к необратимому повреждению головного мозга, коме и даже смерти.
Угарный газ повышается или понижается?
Поэтому он смешивается с окружающим воздухом, не поднимается вверх и более сконцентрирован в той области, где воздух наиболее смешанный, то есть в центре комнаты. Поэтому датчик угарного газа должен быть установлен на уровне глаз, т. е. на расстоянии от 1,5 до 1,7 метра.
Какой уровень угарного газа опасен?
Предельное значение не должно быть превышено. VME (среднее значение воздействия), равное 50 PPM или 55 мг/м3.
Почему угарный газ ядовит?
CO связывается с гемоглобином, образуя карбоксигемоглобин (COHb). Наиболее общепринятая теория состоит в том, что токсичность угарного газа основана на образовании карбоксигемоглобина, эффекте, который снижает способность крови переносить кислород, препятствуя транспортировке, доставке и использованию
Как выделяется угарный газ?
Угарный газ выделяется, когда приборы и транспортные средства сжигают топливо, такое как пропан, древесина, мазут и т. д. Только детектор угарного газа может обнаружить присутствие этого газа и предупредить вас об этом. Когда звучит зуммер, важно знать, что делать.
Что выделяет угарный газ?
Угарный газ (СО) представляет собой бесцветный, не имеющий запаха, токсичный и потенциально смертельный газ, образующийся в результате неполного сгорания независимо от используемого топлива: дрова, бутан, уголь, бензин, мазут, природный газ, нефть, пропан. Он очень быстро диффундирует в окружающую среду.
Как защитить себя от углекислого газа?
В качестве профилактической меры, чтобы избежать отравления угарным газом, проветривайте каждую комнату в доме не менее 10 минут каждый день, даже при низкой температуре. Убедитесь, что вентиляционные отверстия хорошо проветриваются и не закрывают входные и выходные отверстия для воздуха. Также позвольте воздуху циркулировать под дверями.
Может ли CO2 взорваться?
Может взорваться при нагревании. ОПАСНОСТЬ В ЗАМКНУТОМ ПРОСТРАНСТВЕ. Может накапливаться до опасного уровня в низинах, особенно в замкнутых пространствах.
Какой уровень CO2 опасен?
800 частей на миллион: вызывает головные боли, головокружение и тошноту. Такая концентрация СО приводит к потере сознания через 45 мин и смерти через 2-3 часа. 12 800 частей на миллион: вызывает немедленную потерю сознания и смерть от 1 до 3 минут.
Является ли CO парниковым газом?
Двуокись углерода (CO2): в атмосфере присутствует гораздо меньше, чем водяной пар, CO2 участвует в 25% парникового эффекта, потому что его способность удерживать тепло очень высока. Метан (CH4)
Как узнать, есть ли у вас отравление угарным газом?
Вы подвергаетесь риску отравления угарным газом, если в течение нескольких минут после воздействия у вас появляются следующие симптомы:
- Головная боль;
- усталость;
- тошнота;
- рвота;
- головокружение.
Когда образуется угарный газ?
Симптомы — головные боли, утомляемость, тошнота — появляются более или менее быстро и могут затронуть нескольких человек. Тяжелое отравление может привести к коме и смерти, иногда в течение нескольких минут.
Как угарный газ может убить?
Дома существует множество источников выбросов угарного газа: камины, газовые бытовые приборы (плита, духовка, холодильник и т. д.), отопительные системы и водонагреватели внутреннего сгорания; Транспортные средства и другие устройства для сжигания топлива (газонокосилки, снегоочистители и т. д.)
Что такое неполное сгорание?
В отличие от полного сгорания, неполное сгорание происходит, когда количества кислорода недостаточно для полной реакции топлива. При этом образуются дополнительные продукты горения, такие как окись углерода, CO, пепел и дым.
Как образуется СО?
Угарный газ (СО) представляет собой бесцветный, без запаха, токсичный и потенциально смертельный газ, образующийся в результате неполного сгорания независимо от используемого топлива: дров, бутана, угля, бензина, мазута, природного газа, нефти, пропана.
Монооксид углерода, также известный как угарный газ, имеет очень прочный молекулярный состав, является инертным по своим химическим свойствам и плохо растворяется в воде. Это соединение также невероятно токсично, при попадании в органы дыхания оно соединяется с гемоглобином крови, и тот перестает переносить кислород к тканям и органам.
Химические названия и формула
Монооксид углерода известен также под другими названиями, в том числе оксид углерода II. В быту его принято именовать угарным газом. Эта окись углерода является ядовитым бесцветным и безвкусным газом, не имеющим запаха. Его химическая формула – CO, а масса одной молекулы составляет 28,01 г/моль.

Воздействие на организм
Угарный газ соединяется с гемоглобином с образованием карбоксигемоглобина, который не имеет пропускной способности кислорода. Вдыхание его паров вызывает повреждение ЦНС (центральной нервной системы) и удушье. Результирующая нехватка кислорода вызывает головную боль, головокружение, снижение пульса и частоты дыхания, приводит к обмороку и последующей гибели организма.

Токсичный газ
Монооксид углерода получается путем частичного сгорания веществ, содержащих углерод, например, в двигателях внутреннего сгорания. В соединение входит 1 атом углерода, ковалентно связанный с 1 атомом кислорода. Угарный газ очень ядовит, и это один из наиболее распространенных причин смертельных отравлений во всем мире. Воздействие может привести к поражению сердца и других органов.
В чем польза угарного газа?
Несмотря на свою серьезную токсичность, монооксид углерода чрезвычайно полезен – благодаря современным технологиям из него создается целый ряд жизненно важных продуктов. Окись углерода хотя сегодня и считается загрязнителем, всегда присутствовала в природе, однако не в таком количестве, как, например, углекислый газ.
Ошибаются те, кто считает, что не существует соединения монооксид углерода в природе. CO растворяется в расплавленной вулканической породе при высоких давлениях в земной мантии. Содержание оксидов углерода в вулканических газах варьируется от менее 0,01% до 2%, в зависимости от вулкана. Поскольку природные этого соединения не являются величиной постоянной, точно измерить естественные выбросы газа не представляется возможным.

Химические свойства
Монооксид углерода (формула CO) относится к несолеобразующим или безразличным оксидам. Однако, при температуре +200 oС он вступает в реакцию с гидроксидом натрия. Во время этого химического процесса происходит образование формиата натрия:
NaOH + CO = HCOONa (соль муравьиной кислоты).
Свойства монооксида углерода основаны на его восстановительной способности. Монооксид углерода:
- может вступать в реакцию с кислородом: 2CO + O2 = 2CO2;
- способен взаимодействовать с галогенами: CO + Cl2 = COCl2 (фосген);
- имеет уникальное свойство восстанавливать чистые металлы из их оксидов: Fe2O3 + 3CO = 2Fe + 3CO2;
- образует карбонилы металлов: Fe + 5CO = Fe(CO)5;
- прекрасно растворяется в хлороформе, уксусной кислоте, этаноле, гидроксиде аммония и бензоле.
Структура молекулы
Два атома, из которых, собственно, и состоит молекула окиси углерода (СО), связаны между собой тройной связью. Две из них образованы путем слияния p-электронов атомов углерода с кислородом, а третья – благодаря особому механизму за счет свободной 2р-орбитали углерода и 2р-электронной пары кислорода. Такая структура обеспечивает молекуле высокую прочность.
Немного истории
Еще Аристотель из древней Греции описывал токсичные пары, производимые горящими углями. Сам механизм смерти известен не был. Однако одним из древних методов казни было запирание преступившего закон в парной, где находились тлеющие угли. Греческий врач Гален предположил, что в составе воздуха происходят определенные изменения, которые причиняют вред при вдыхании.
Во время Второй мировой войны газовая смесь с примесями монооксида углерода, была применена в качестве топлива для автотранспортных средств в тех частях мира, где было ограниченное количество бензина и дизельного топлива. Были установлены внешние (за некоторыми исключениями) генераторы древесного угля или древесного газа, а смесь атмосферного азота, моноксида углерода и небольшого количества других газов подавалась в газовый смеситель. Это был так называемый древесный газ.
Окисление монооксида углерода
Окись углерода образуется при частичном окислении углеродсодержащих соединений. СО образуется, когда кислорода недостаточно для производства двуокиси углерода (CO2), например, при работе печи или двигателя внутреннего сгорания в замкнутом пространстве. Если присутствует кислород, а также некоторые другие атмосферные концентрации, окись углерода горит, излучая синий свет, образуя двуокись углерода, известную как углекислый газ.
Угольный газ, широко применяемый до 1960 годов прошлого века для внутреннего освещения помещений, приготовления пищи и отопления, имел СО в составе в качестве преимущественного компонента топлива. Некоторые процессы в современных технологиях, таких как выплавка железа, все еще производят монооксид углерода в качестве побочного продукта. Само соединение СО окисляется в СО2 при комнатной температуре.
Есть ли СО в природе?
Существует ли монооксид углерода в природе? Одним из его естественных по происхождению источников являются фотохимические реакции, происходящие в тропосфере. Эти процессы, как предполагается, способны генерировать около 5×1012 кг вещества е;егодно. Среди других источников, как уже было сказано выше, находятся вулканы, лесные пожары и другие виды горения.
Молекулярные свойства
Монооксид углерода имеет молярную массу 28,0, что делает его немного менее плотным, чем воздух. Длина связи между двумя атомами – 112,8 микрометров. Это достаточно близко, что обеспечивает одну из самых сильных химических связей. Оба элемента в соединении СО вместе имеют около 10 электронов в одной валентной оболочке.
Остальные две связанные орбитали занимают одну заряженную частицу от углерода и одну от кислорода. Молекула является асимметричной: кислород имеет большую плотность электронов, чем углерод, и также слегка положительно заряжен по сравнению с отрицательным углеродом.
Получение
В промышленности получение монооксид углерода СО осуществляется путем нагревания без доступа воздуха углекислого газа или водяных паров с углем:
СО2 + С = 2СО;
Н2О + С = СО + Н2.
Последнюю получившуюся смесь еще называют водяным или синтез-газом. В лабораторных условиях оксид углерода II путем воздействия на органические кислоты концентрированной серной кислоты, которая выступает в качестве водоотнимающего средства:
НСООН = СО + Н2О;
Н2С2О4 = СО2 + Н2О.
Основные симптомы и помощь при отравлении СО
Вызывает ли монооксид углерода отравление? Да, и очень сильное. Отравление угарным газом является наиболее частым явлением во всем мире. Наиболее распространенные симптомы:
- чувство слабости;
- тошнота;
- головокружение;
- усталость;
- раздражительность;
- плохой аппетит;
- головная боль;
- дезориентация;
- нарушение зрения;
- рвота;
- обморок;
- судороги.
Воздействие этого токсичного газа может привести к значительным повреждениям, которые зачастую могут привести к длительными хроническим патологическим состояниям. Монооксид углерода способен причинить серьезный ущерб плоду беременной женщины. Пострадавшим, например, после пожара, следует оказать незамедлительную помощь. необходимо срочно вызвать скорую помощь, дать доступ свежего воздуха, убрать стесняющую дыхание одежду, успокоить, согреть. Сильное отравление, как правило, лечится только под присмотром врачей, в стационаре.
Применение
Угарный газ, как уже было сказано, ядовит и опасен, однако он является одним из базовых соединений, которые применяются в современной промышленности для органического синтеза. СО используют для получения чистых металлов, карбонилов, фосгена, сероокиси углерода, метилового спирта, формамида, ароматических альдегидов, муравьиной кислоты. Это вещество также применяется в качестве горючего. Несмотря на его токсичность и ядовитость, его часто используют в качестве сырья для получения различных веществ в химической промышленности.
Угарный газ и углекислый газ
Монооксид и диоксид углерода (СО и CO2) часто ошибочно принимают друг за друга. Оба газа без запаха и цвета, и оба негативно воздействуют на сердечно-сосудистую систему. Оба газа могут проникать в организм через вдыхание, кожу и глаза. Эти соединения при воздействии на живой организм имеют ряд общих симптомов – головные боли, головокружение, судороги и галлюцинации. Большинство людей с трудом определяют разницу и не понимают, что выхлопные газы автомобилей испускают как CO, так и CO2 . В помещении увеличение концентрации этих газов может быть опасным для здоровья и безопасности человека, подверженного их воздействию. В чем же разница?
При высоких концентрациях оба могут быть смертельными. Разница заключается в том, что CO2 является общим природным газом, необходимым для всей растительной и животной жизни. CO не является обычным явлением. Это побочный продукт бескислородного сжигания топлива. Критическое химическое различие заключается в том, что CO2 содержит один атом углерода и два атома кислорода, тогда как у CO их всего по одному. Углекислый газ является негорючим, в то время как монооксид имеет большую вероятность к воспламенению.
Двуокись углерода, естественно, встречается в атмосфере: люди и животные дышат кислородом и выдыхают углекислый газ, то есть живые существа способны выдерживать его в небольшом количестве. Этот газ необходим также для осуществления растениями фотосинтеза. Однако монооксид углерода не возникает естественным образом в атмосфере и может вызвать проблемы со здоровьем даже в низких концентрациях. Плотность обоих газов также различна. Углекислый газ тяжелее и плотнее воздуха, в то время как монооксид углерода немного легче. Эту их особенность стоит учитывать при установлении в домах соответствующих датчиков.
Многие газообразные вещества, существующие в природе и получаемые при производствах, являются сильными отравляющими соединениями. Известно, что хлор использовался как биологическое оружие, пары брома обладают сильно разъедающим действием на кожу, сероводород вызывает отравление и так далее.
Одним из таких веществ является и монооксид углерода или угарный газ, формула которого имеет свои особенности в структуре. О нем и пойдет речь дальше.

Химическая формула угарного газа
Эмпирический вид формулы рассматриваемого соединения следующий: СО. Однако такая форма дает характеристику лишь о качественном и количественном составе, но не затрагивает особенности строения и порядок соединения атомов в молекуле. А он отличается от такового во всех прочих подобных газах.
Именно эта особенность влияет на проявляемые соединением физические и химические свойства. Какая же это структура?
Строение молекулы
Во-первых, по эмпирической формуле видно, что валентность углерода в соединении равна II. Так же, как и у кислорода. Следовательно, каждый из них может сформировать по две связи. Химическая формула угарного газа СО это наглядно подтверждает.
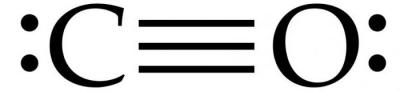
Так и происходит. Между атомом углерода и кислорода по механизму обобществления неспаренных электронов происходит образование двойной ковалентной полярной связи. Таким образом, структурная формула угарного газа принимает вид С=О.
Однако на этом особенности молекулы не заканчиваются. По донорно-акцепторному механизму в молекуле происходит формирование третьей, дативной или семиполярной связи. Чем это объясняется? Так как после образования ковалентных связей по обменному порядку у кислорода остается две пары электронов, а у атома углерода – пустая орбиталь, то последний выступает в роли акцептора одной из пар первого. Другими словами, пара электронов кислорода размещается на свободной орбитали углерода и происходит образование связи.

Так, углерод – акцептор, кислород – донор. Поэтому формула угарного газа в химии принимает следующий вид: С≡О. Такая структуризация сообщает молекуле дополнительную химическую стабильность и инертность в проявляемых свойствах при обычных условиях.
Итак, связи в молекуле монооксида углерода:
- две ковалентные полярные, образованные по обменному механизму за счет обобществления неспаренных электронов;
- одна дативная, сформированная по донорно-акцепторному взаимодействию между парой электронов и свободной орбиталью;
- всего связей в молекуле – три.
Физические свойства
Есть ряд характеристик, которыми, как и любое другое соединение, обладает угарный газ. Формула вещества четко дает понять, что кристаллическая решетка молекулярная, состояние при обычных условиях газообразное. Отсюда вытекают следующие физические параметры.
- С≡О – угарный газ (формула), плотность – 1,164 кг/м3.
- Температура кипения и плавления соответственно: 191/205 0С.
- Растворяется в: воде (незначительно), эфире, бензоле, спирте, хлороформе.
- Не имеет вкуса и запаха.
- Бесцветен.
С биологической точки зрения крайне опасен для всех живых существ, кроме определенных видов бактерий.

С точки зрения химической активности, одно из самых инертных веществ при обычных условиях – это угарный газ. Формула, в которой отражены все связи в молекуле, подтверждает это. Именно из-за такой прочной структуры данное соединение при стандартных показателях окружающей среды практически не вступает ни в какие взаимодействия.
Однако следует хотя бы немного нагреть систему, как дативная связь в молекуле рушится, как и ковалентные. Тогда монооксид углерода начинает проявлять активные восстановительные свойства, причем достаточно сильные. Так, он способен взаимодействовать с:
- кислородом;
- хлором;
- щелочами (расплавы);
- с оксидами и солями металлов;
- с серой;
- незначительно с водой;
- с аммиаком;
- с водородом.
Поэтому, как уже оговаривалось выше, свойства, которые проявляет угарный газ, формула его во многом объясняет.

Нахождение в природе
Основной источник СО в атмосфере Земли – лесные пожары. Ведь главный способ образования данного газа естественным путем – это неполное сгорание различного вида топлива, в основном органической природы.
Антропогенные источники загрязнения воздуха монооксидом углерода так же немаловажны и дают по массовой доле такой же процент, как и природные. К ним относятся:
- дым от работы фабрик и заводов, металлургических комплексов и прочих промышленных предприятий;
- выхлопные газы из двигателей внутреннего сгорания.
В природных условиях угарный газ легко окисляется кислородом воздуха и парами воды до углекислого газа. На этом основана первая помощь при отравлении этим соединением.

Стоит указать одну особенность. Угарный газ (формула), углекислый газ (строение молекулы) соответственно выглядят так: С≡О и О=С=О. Разница на один атом кислорода. Поэтому промышленный способ получения монооксида основан на реакции между диоксидом и углем: СО2 + С = 2СО. Это самый простой и распространенный способ синтеза данного соединения.
В лаборатории используют различные органические соединения, соли металлов и комплексные вещества, так как выход продукта не ожидают слишком большим.
Качественный реагент на наличие в воздухе или растворе угарного газа – хлорид палладия. При их взаимодействии формируется чистый металл, который вызывает потемнение раствора или поверхности бумаги.

Биологическое действие на организм
Как уже оговаривалось выше, угарный газ – это очень ядовитый бесцветный, опасный и смертоносный вредитель для человеческого организма. Да и не только именно человеческого, а вообще любого живого. Растения, которые находятся под воздействием выхлопных газов автомобилей, гибнут очень быстро.
В чем же именно заключается биологическое воздействие монооксида углерода на внутреннюю среду животных существ? Все дело в формировании прочных комплексных соединений белка крови гемоглобина и рассматриваемого газа. То есть вместо кислорода захватываются молекулы яда. Клеточное дыхание мгновенно блокируется, газообмен становится невозможным в нормальном его течении.
В результате происходит постепенная блокировка всех молекул гемоглобина и, как следствие, смерть. Достаточно поражения всего на 80%, чтобы исход отравления стал летальным. Для этого концентрация угарного газа в воздухе должна составлять 0,1 %.
Первыми признаками, по которым можно определить наступление отравления этим соединением, являются:
- головная боль;
- головокружение;
- потеря сознания.
Первая помощь – выйти на свежий воздух, где угарный газ под влиянием кислорода превратится в углекислый, то есть обезвредится. Случаи смертей от действия рассматриваемого вещества очень часты, особенно в домах с печным отоплением. Ведь при сгорании дров, угля и другого вида топлива в качестве побочного продукта обязательно образуется этот газ. Соблюдение правил техники безопасности крайне важно для сохранения жизни и здоровья человека.
Также много случаев отравления в гаражных помещениях, где собрано много работающих двигателей автомобилей, но недостаточно подведен приток свежего воздуха. Смерть при превышении допустимой концентрации наступает уже через час. Ощутить присутствие газа физически невозможно, ведь ни запаха, ни цвета у него нет.

Использование в промышленности
В металлургической промышленности для реакций восстановления металлов из их оксидов или солей используется часто именно угарный газ. Формула образующегося в результате соединения – СО2. Также формируется чистое вещество – металл.
Кроме того, монооксид углерода применяют:
- для обработки мясных и рыбных продуктов, что позволяет придать им свежий вид;
- для синтезов некоторых органических соединений;
- как компонент генераторного газа.
Поэтому это вещество является не только вредоносным и опасным, но еще и весьма полезным для человека и его хозяйственной деятельности.
Разница между оксидом углерода и диоксидом углерода
Углекислый газ и угарный газ представляют собой комбинацию углерода и кислорода, поэтому их названия похожи. Но эти газы образуются в результате различных химических реакций.
Откуда берется углекислый газ?
Двуокись углерода является результатом полного сгорания. Полное сгорание – это химическая реакция, в которой углеводород реагирует с кислородом с образованием диоксида углерода и воды. Полное сгорание часто (но не всегда) связано с пламенем. Вы наблюдаете полное сгорание свечи, наблюдая за горением свечи: воск свечи – это углеводород, который вступает в реакцию с кислородом воздуха и теплом зажженного фитиля. Двуокись углерода выбрасывается в воздух в виде газа без цвета и запаха. Это в значительной степени нереактивный газ, и после выпуска он быстро смешивается с атмосферой.
Двуокись углерода также производится в промышленных процессах. Промышленные предприятия, которые производят водород или аммиак из природного газа, угля или операций по ферментации в больших объемах, являются одними из крупнейших коммерческих производителей диоксида углерода. Двуокись углерода находит множество применений в пищевой промышленности и производстве напитков , включая газированные напитки.
Откуда берется окись углерода?
Окись углерода , с другой стороны, является результатом неполного сгорания. Неполное сгорание происходит, когда поступление воздуха ограничено, поэтому к углероду добавляется только половина кислорода, образуя монооксид углерода (CO = один атом кислорода, CO2 = два атома кислорода).
В отличие от двуокиси углерода, окись углерода не встречается в атмосфере в естественных условиях. Он создается в результате неполного сгорания угля, природного газа и нефти. Низкий уровень кислорода и низкие температуры приводят к образованию окиси углерода в смеси сгорания.
Опасные уровни окиси углерода могут быть произведены любым устройством сжигания топлива, включая газовые печи, газовые плиты, газовые осушители, газовые водонагреватели, камины и автомобили. Как бесцветный газ без запаха, вы не можете идентифицировать его без газовых детекторов .
В промышленных условиях двигатель внутреннего сгорания является основным источником окиси углерода. Многие печи и духовки производят большое количество газа, особенно когда они не обслуживаются должным образом. Водители грузовиков, операторы вилочных погрузчиков или люди, работающие рядом с этим типом оборудования, подвергаются более высокому риску воздействия угарного газа. Рабочие вблизи или в закрытых помещениях или замкнутых пространствах, таких как люки, гаражи, туннели, погрузочные платформы, склады, мастерские по ремонту транспортных средств и машины для сращивания, также подвергаются риску.
Хотя оксид углерода обычно является нежелательным побочным продуктом, упакованный оксид углерода используется в различных отраслях промышленности, включая производство металлов, химическое производство, фармацевтику, электронные и полупроводниковые приложения, а также для восстановления руд при производстве карбонилов металлов.
Риски для здоровья, связанные с оксидом углерода и диоксидом углерода
Хотя отравление углекислым газом случается редко, его высокая концентрация в замкнутом пространстве может быть токсичной. Избыток углекислого газа использует пространство в воздухе вместо кислорода , создавая среду для удушья. Симптомы легкого отравления углекислым газом включают головные боли и головокружение при концентрациях менее 30 000 ppm. При 80 000 ppm CO2 может быть опасным для жизни. В качестве справки OSHA (Управление по безопасности и гигиене труда) установило допустимый предел воздействия CO2 (PEL) на уровне 5 000 ppm в течение восьмичасового периода и 30 000 ppm в течение 10-минутного периода.
Окись углерода – гораздо более опасный газ. Окись углерода, также называемая «тихим убийцей», представляет собой газ без цвета, запаха, вкуса и раздражения, поэтому ранние признаки отравления трудно обнаружить.
Окись углерода, монооксид углерода, угарный газ (СО)
Окись углерода – это бесцветный газ без запаха и вкуса. Он легко воспламеняется и довольно токсичен для людей и других организмов, дышащих кислородом.
Окись углерода присутствует в атмосфере Земли в очень низких концентрациях. Типичная концентрация CO в тропосфере Земли составляет около 100 частей на миллиард (означает, что из каждого миллиарда молекул воздуха – одна оксида углерода). Окись углерода имеет типичную «продолжительность жизни»в несколько месяцев в атмосфере Земли. В конечном итоге газ вступает в реакцию с кислородом (O2) с образованием диоксида углерода (CO2).
Окись углерода является наиболее распространенным по массе загрязняющим газом. Содержание окиси углерода в атмосфере в типичных городских районах составляют около 10 ppm (частей на миллион), что примерно в 100 раз выше, чем в атмосфере Земли в целом.
Окись углерода является относительно инертным соединением, поэтому не представляет особой угрозы для растений или подвергающихся его воздействию материалов. Однако этот газ довольно ядовит для людей и других дышащих воздухом существ, которым нужен кислород. Гемоглобин, который переносит кислород из легких в клетки по всему телу, более чем в 200 раз более склонен к связыванию с монооксидом углерода, чем с кислородом. Это означает, что у человека, который вдыхает слишком много CO, гемоглобин может насыщаться им, что делает невозможным доставку кислорода к клеткам крови.
Окись углерода часто является продуктом неполного сгорания. Если во время горения присутствует слишком мало кислорода или слишком много углерода, при горении образуется окись углерода (CO) вместо углекислого газа (CO2). Плохо вентилируемые керосиновые фонари и печи могут генерировать опасно высокий уровень окиси углерода в закрытых помещениях.
Поскольку для полного смешивания CO в тропосфере требуется больше времени, чем выживает молекула CO (до окисления до CO2), окись углерода имеет локально повышенные или пониженные концентрации вблизи источников где он образуется или выбрасывается в атмосферу. Таким образом, измерения концентрации CO могут помочь найти источники образования этого газа.
Окись углерода косвенно способствует накоплению некоторых парниковых газов в тропосфере. Он вступает в реакцию с определенными веществами, которые разрушают метан и озон, тем самым помогая повысить концентрацию метана и озона.
Окись углерода (угарный газ), как парниковый газ
Окись углерода (CO) – это очень слабый парниковый газ, но он оказывает важное косвенное влияние на глобальное потепление. Окись углерода реагирует с гидроксильными (ОН) радикалами в атмосфере, уменьшая их количество. Поскольку радикалы (ОН) помогают сократить время жизни сильных парниковых газов, таких как метан, окись углерода косвенно увеличивает потенциал глобального потепления этих газов.
Окись углерода в атмосфере также может приводить к образованию тропосферного парникового газа «озона». Концентрация окиси углерода в атмосфере широко варьируется во всем мире в течение года, от 30 частей на миллиард до примерно 200 частей на миллиард. Концентрации увеличились в течение 20-го века, но есть некоторые признаки того, что концентрации снизились в 1990-х годах из-за широкого использования каталитических нейтрализаторов с более низкими выбросами окиси углерода в автомобилях.
Человеческое воздействие
Сегодня более половины выбросов окиси углерода являются антропогенными. Самые высокие концентрации окиси углерода, как правило, наблюдаются вблизи районов с высокой численностью населения. В глобальном масштабе это означает, что более густонаселенное северное полушарие имеет более высокие концентрации окиси углерода, чем южное полушарие. Сжигание биомассы и использование ископаемого топлива являются основными источниками антропогенных выбросов окиси углерода.
Диоксид углерода, углекислый газ (CO2)
Двуокись углерода – бесцветный и негорючий газ при нормальной температуре и давлении. Хотя двуокись углерода гораздо менее распространена, чем азот и кислород в атмосфере Земли , она является важной составляющей воздуха на нашей планете.
Двуокись углерода – важный парниковый газ, который помогает удерживать тепло в нашей атмосфере. Без него наша планета была бы неприветливо холодной.
Однако постепенное увеличение концентрации CO2 в атмосфере Земли способствует глобальному потеплению, поскольку средние глобальные температуры постепенно повышаются.
Двуокись углерода – четвертый по распространенности компонент сухого воздуха. Его концентрация в атмосфере Земли составляет около 400 ppmv (частей на миллион по объему). По оценкам ученых, до начала промышленной деятельности человека концентрация CO2 составляла около 270 ppmv. Таким образом, с начала индустриализации человечества уровни углекислого газа в нашей атмосфере выросли примерно на 40 %, и ожидается, что это сыграет соответствующую роль в повышении глобальной температуры.
Углекислый газ играет ключевую роль в углеродном цикле Земли , в совокупности процессов, которые приводят в цикл углерод во многих формах в нашей окружающей среде. Вулканическое выделение газа и лесные пожары – два важных естественных источника образования CO2 в атмосфере Земли.
В результате фотосинтеза, биохимического процесса, с помощью которого растения и некоторые микробы создают пищу, идет потребление углекислого газа.
Таким образом, углекислый газ улавливается растительностью.
Фотосинтезирующие организмы объединяют CO2 и воду (H2O) для производства углеводов (например, сахаров) и выделяют кислород в качестве побочного продукта. Леса и океаны, в которых поддерживаются фотосинтезирующие микробы, действуют как массивные “стоки” углерода, удаляя углекислый газ из атмосферы посредством фотосинтеза.
Углекислый газ – самый распространенный газ в атмосферах Марса и Венеры. Твердая замороженная двуокись углерода называется «сухим льдом». Полярные ледяные шапки Марса представляют собой смесь обычного водяного льда и сухого льда.
Жидкий CO 2 образуется только при давлении, превышающем примерно в 5 раз атмосферное давление на Земле на уровне моря, поэтому во многих ситуациях сухой лед не тает в жидкую форму. Вместо этого он переходит непосредственно из твердого состояния в газообразное в процессе, называемом сублимацией.
Углекислый газ как парниковый газ
Углекислый газ вносит свой вклад в изменение климата из-за своего положительного радиационного воздействия. В общем объеме выбросов преобладают выбросы от электростанций, нефтеперерабатывающих заводов и других потребителей ископаемого топлива.
Двуокись углерода – самый важный из долгоживущих парниковых газов Земли . Он поглощает меньше тепла на молекулу, чем парниковый газ метан или закись азота, но его больше, и он остается в атмосфере намного дольше.
Другая причина, по которой углекислый газ важен для системы Земли, заключается в том, что он растворяется в океане, как газировка в банке. Он реагирует с молекулами воды, производя углекислоту и понижая pH океана (повышая его кислотность). С начала промышленной революции pH поверхностных вод океана упал с 8,21 до 8,10. Это падение pH называется закислением океана .
Падение на 0,1 может показаться не таким уж большим, но шкала pH логарифмическая: падение pH на 1 единицу означает десятикратное увеличение кислотности. Изменение на 0,1 означает увеличение кислотности примерно на 30%. Повышенная кислотность препятствует способности морских обитателей извлекать из воды кальций для создания своих раковин и скелетов.
Углекислый газ в прошлом
Когда снег падает и превращается в лед, он захватывает крошечные пузырьки воздуха. Эти атмосферные «капсулы времени» хранят образцы различных газов, из которых состоял воздух при затвердевании льда. А поскольку ледяные керны – и пузырьки внутри них – можно датировать, ученые могут узнать не только, сколько CO2 было в атмосфере в любой момент времени, но и как концентрация CO2 изменилась с годами
CO2 в атмосфере измеряется в миллионных долях или миллионных долях. Например, современная концентрация CO2 превышает 385 частей на миллион. Это означает, что на каждые 1 000 000 молекул газа в воздухе приходится 385 CO2 . Другими словами, воздух содержит 0,0385% CO 2 .
По крайней мере, 800000 лет концентрация CO2 в атмосфере никогда не поднималась выше 300 частей на миллион. Сегодня она превышает 385 частей на миллион и растет примерно на 2 частей на миллион в год.
Температура и CO2 идут в ногу. На протяжении сотен тысяч лет температура и содержание CO2 в атмосфере одновременно повышались и понижались. Но прошлые изменения температуры, похоже, не были вызваны изменениями в CO2 . Скорее, изменения в ориентации Земли к Солнцу неоднократно заставляли планету нагреваться или охлаждаться. Затем последовали изменения в CO2 . Поскольку океан играет ключевую роль в контроле концентрации CO2 в атмосфере, потепление и охлаждение, вероятно, повлияли на способность океана поглощать CO2 , что, в свою очередь, могло усилить потепление или охлаждение за счет парникового эффекта.
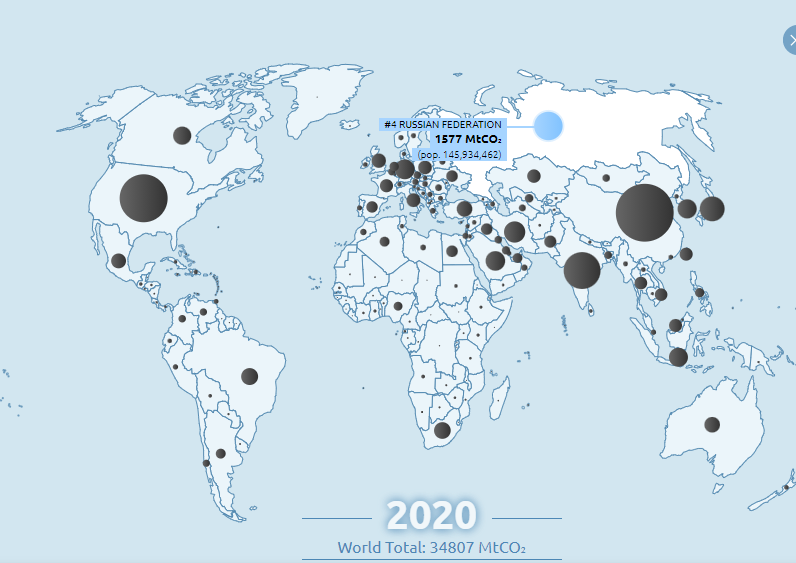
ВЫБРОСЫ УГЛЕКИСЛОГО ГАЗА ПО СТРАНАМ
Даже если человечество немедленно прекратит выбросы CO2 , дополнительный углерод, который мы уже вложили в атмосферу, будет продолжать изменять наш климат, поскольку он медленно истощается – и это может занять столетия. или тысячелетия.
Использование лесовосстановления для удаления CO2
Одной из запланированных мер по предотвращению выброса слишком большого количества CO2 в атмосферу является лесовосстановление. Согласно исследованиям, 3,6 миллиарда тонн CO2 – около 10% текущих выбросов CO2 – можно уменьшить в атмосфере каждый год за счет лесопосадок. Однако исследование, проведенное исследователями из Швейцарского федерального технологического института ETH Zurich, подчеркивает, что для достижения этой цели потребуется использование земельных участков, эквивалентных по размеру территории США.
Удаление углекислого газа с помощью гумуса в почве
Гумус в почве хранит много углерода . Количество гумуса в почве можно увеличить, используя промежуточные культуры и растения с глубокими корнями, а также заглубляя остатки урожая в землю и избегая глубокой вспашки. Согласно исследованию Немецкого института международных отношений и безопасности (SWP) по использованию целевого выделения CO2 в рамках климатической политики ЕС, от двух до пяти миллиардов тонн CO2 можно сэкономить за счет глобального накопления запасов гумуса.
Хранение CO2 в земле
Хранение CO2 глубоко под землей уже хорошо известно и практикуется, например, на нефтяных месторождениях Норвегии. Однако этот процесс все еще вызывает споры, поскольку хранение CO2 под землей может привести к землетрясениям и утечкам в долгосрочной перспективе. В Исландии в настоящее время практикуют другой метод, при котором СО2 изолируется в пористую базальтовую породу для минерализации в камень. Однако оба метода все еще требуют дополнительных исследований.
Улавливание углекислого газа под землей осуществляется с помощью химических процессов, которые эффективно извлекают газ из окружающего воздуха. Этот метод известен как прямой захват воздуха (DAC) и уже практикуется в других частях Европы. Поскольку количество улавливаемого CO2 не ограничено, считается, что он имеет большой потенциал. Однако главным недостатком является стоимость – в настоящее время около 550 евро (650 долларов США) за тонну. Некоторые ученые считают, что массовое производство систем DAC может снизить цены до 50 евро за тонну к 2050 году. Это уже считается ключевой технологией для защиты климата будущего.
Удаление CO2 применением минералов горных пород
В этом процессе карбонатные и силикатные породы добываются, измельчаются и разбрасываются на сельскохозяйственных угодьях или в поверхностных водах океана, где они собирают СО2 в течение многих лет. По мнению исследователей, к середине этого века с помощью этого метода можно будет улавливать от двух до четырех миллиардов тонн CO2 ежегодно. Основными проблемами являются, прежде всего, необходимое количество камня и создание необходимой инфраструктуры.

Угарным газом называют оксид углерода с формулой CO. Кроме того, это соединение называют монооксидом и окисью углерода. Он представляет собой бесцветный безвкусный горючий газ без запаха, который легче воздуха. Вещество образуется в случаях, когда топливо сгорает не до конца. Оно плохо растворяется в воде.
У молекулы этого оксида линейное строение. Между атомами его элементов образуется тройная связь. Два неспаренных электрона обоих элементов образуют пару ковалентных связей. Третья же связь возникает, когда электронная пара кислорода размещается на свободной орбитали атома углерода.
У молекулы слабая полярность. Наличие двух неспаренных электронов говорит о том, что в этом соединении углерод проявляет валентность II.
Оксид углерода (II) не образует солей и является восстановителем. Кроме того, к химическим свойствам угарного газа относятся:

- Горение синим пламенем в кислородной атмосфере.
- При повышенном давлении вещество вступает во взаимодействие с водородом. Из этой смеси, называемой синтез-газом, при различных условиях получают углеводороды, например, метан.
- При наличии давления оксид углерода (II) вступает в реакцию с щелочами. В результате появляется соль муравьиной кислоты.
- Восстановление металлов из оксидов. К примеру, взаимодействие с оксидом железа (III) даёт железо и углекислый газ.
- Реакции с сильными окислителями приводят к образованию углекислого газа или карбонатов.
Способы изготовления
Получить монооксид можно как в лабораторных условиях, так и в производственных. В первом случае для образования необходимого вещества используют концентрированную серную и муравьиную или щавелевую кислоты.

В промышленности для получения угарного газа применяют специальные газогенераторы. В них соединение вырабатывается воздухом, проходящим через раскалённый уголь. Ещё одним промышленным методом изготовления газа является паровая конверсия метана или угля. Кроме того, на производстве используют процесс неполного окисления метана.
Угарный газ присутствует и в атмосфере планеты. Он туда поступает тремя способами:
- неполное разложение органических веществ без доступа воздуха;
- сгорание биологической массы, например, лесные и степные пожары;
- выхлопные газы, которые образуются в двигателях внутреннего сгорания.
Использование соединения
Основное применение горючего вещества — изготовление генераторного или воздушного газа, для чего монооксид смешивают с азотом. Кроме того, соединяя его с водородом, получают водяной газ.
В металлургической промышленности из-за химической характеристики угарный газ используется в качестве восстановителя металлов из их руд. Также окись применяют при разложении карбонилов, что позволяет получить высокочастотные металлы.
Влияние на живые организмы
Монооксид крайне токсичен, потому что связывается с находящимся в крови гемоглобином прочнее и во много раз быстрее кислорода. Он блокирует процессы доставки жизненно необходимого вещества.
Если концентрация вещества в атмосфере превышает 0,1%, то живые организмы погибают в течение одного часа. Если же уровень оксида этого типа поднимается до 0,3%, то смерть наступает в течение нескольких минут. По этим причинам угарный газ относится к быстродействующим отравляющим веществам.

Специалистами установлено, что чаще всего люди погибают при пожарах в результате отравления указанным углеродным соединением, поскольку он является неотъемлемым продуктом горения большинства материалов. Кроме того, оксид вырабатывается двигателями автомобилей, что также приводит к гибели неосторожных граждан, например, механиков, которые пренебрегают организацией должной вентиляции в гараже.
Если отравление лёгкой степени, то пострадавшему для восстановления здоровья будет достаточно гипервентиляции лёгких кислородом. Если же отравление тяжёлое, то человеку потребуется серьёзная медицинская помощь.

Углекислый газ, двуокись или оксид углерода (IV) представляет собой газообразное бесцветное вещество, не имеющее запаха. Его химическая формула — CO2. Двуокись не горит и в минимальных концентрациях не представляет опасности для организма. Также она является необходимым элементом для нормальной жизнедеятельности растений.
Это соединение кислорода и углерода примерно в полтора раза тяжелее воздуха. Оно плохо растворяется в воде, а при повышении давления или охлаждении оксид становится твёрдым. Твёрдая углекислота известна под названием «сухой лёд». Она отличается способностью переходить из твёрдого состояния в газообразное, минуя жидкое.
У вещества линейная молекула. Из-за четырёх неспаренных электронов в своих соединениях углерод проявляет валентность, равную IV.
Атом углерода в этом соединении имеет пару двойных связей с кислородными атомами. Полярность четырёх связей делает молекулу двуокиси неполярной. Это хорошо видно в структурной формуле оксида, которая наглядно демонстрирует связь атомов внутри молекулы:
Взаимодействие с другими веществами
В химии углекислота считается солеобразующим оксидом, проявляющим слабые свойства окислителя. Она прекрасно взаимодействует с водой, причём эта реакция является практически полностью обратимой.
Вещество имеет следующие химические свойства:

- Вступление в реакцию с основными оксидами и основаниями. Соединение взаимодействует лишь с щелочами и их оксидами. При этом могут образовываться кислые и средние соли. К примеру, гидроксид калия в таком случае образует гидрокарбонат калия, который является кислой солью. Если же щелочи много, то получится карбонат калия — средняя соль.
- Взаимодействие с карбонатами с последующим образованием гидрокарбонатов.
- Реакции с некоторыми восстановителями, например, с углеродом, магнием и пероксидом натрия.
Методы получения
Углекислый газ получают и в лабораториях, и в промышленности. В лабораторных условиях для его производства применяются следующие методы:
- Воздействие сильными кислотными веществами на карбонаты и гидрокарбонаты различных металлов.
- Углекислое соединение образуется, когда растворимые карбонаты реагируют с растворимыми солями алюминия, железа (III) и хрома (III).
- Разложение растворимых гидрокарбонатов и нерастворимых карбонатов при высоких температурах.
На производстве двуокись получают из печных газов, а также из продуктов разложения известняка и доломита. Для этого смесь веществ промывают раствором карбоната калия. Реагент поглощает углекислоту и становится гидрокарбонатом. Получившееся вещество нагревают, что приводит к его разложению и высвобождению оксида углерода. Затем газ закачивают в баллоны.
Применение углекислоты
Химические и физические характеристики соединения позволяют использовать его в самых разных областях. Так, вещество активно применяется в химической промышленности, металлургии и при производстве бумаги.

А также углекислота применяется в следующих сферах деятельности:
- сварка;
- сельское хозяйство;
- медицина;
- фармацевтика;
- приборы и оборудование;
- защита окружающей среды;
- пищевая промышленность;
- пневматическое оружие.
Очень востребован этот вид оксида углерода в системах пожаротушения. Им наполняют специальные огнетушители. Их принцип действия основан на том, что углекислота не горит и весит больше воздуха. За счёт этого вещество окутывает очаг возгорания и перекрывает для огня источник кислорода, которые необходим для поддержания процесса горения. В таких условия пламя довольно быстро гаснет.
Физиологическое действие
Углекислота — нетоксичное вещество. Но если в воздухе её становится слишком много, то все живые организмы, дышащие кислородом, могут испытывать приступы удушья, способные привести к смерти. По этой причине углекислому газу присвоен четвёртый класс опасности.
Если уровень находящегося в воздухе углеродного соединения составляет от 2 до 4%, то человек чувствует сонливость и слабость. Когда концентрация двуокиси достигает 7—10%, начинают появляться симптомы удушья, похожи на признаки высотной болезни:

- головная боль;
- головокружение;
- слуховые расстройства;
- потеря сознания.
Чем выше концентрация газа в атмосфере, тем длительнее проявляются симптомы. При очень высокой концентрации оксида человек или животное быстро погибает от удушья, которое вызывается гипоксией.
Само по себе вдыхание воздуха с высоким содержанием двуокиси неопасно, а потому не влечёт за собой длительных проблем со здоровьем. После того как пострадавший переносится в атмосферу с обычным уровнем углекислоты, его самочувствие приходит в норму.








